Содержание
- 2. Основные типы процессов протекания химических реакций в реакторе Порядок и молекулярность реакции Элементы формальной кинетики Простая
- 3. Две параллельные реакции простого порядка Последовательные реакции Обратимые реакции первого порядка Зависимость скорости от температуры Энергия
- 4. Химическая кинетика — наука о скоростях химических реакций. Химическая кинетика изучает законы протекания химических реакций во
- 5. На скорость химической реакции оказывают влияние все условия ее протекания: природа реагирующих веществ, их фазовое состояние,
- 6. Химические процессы обычно осуществляются двумя способами: , 1) статическим — в замкнутых закрытых реакторах при постоянном
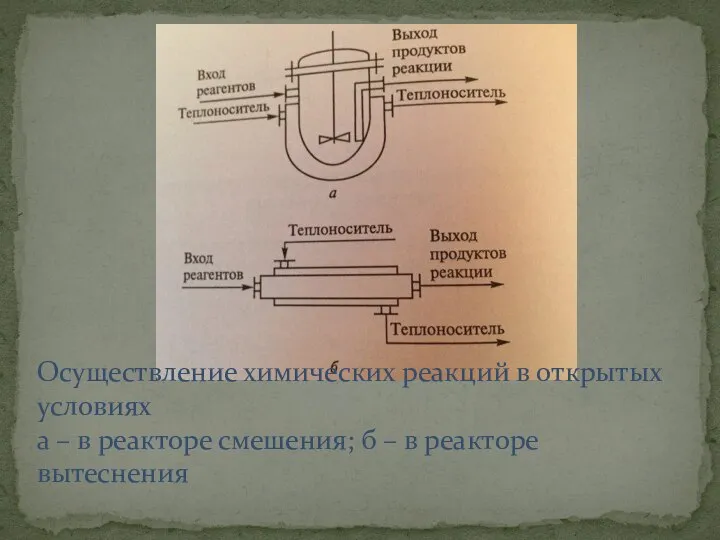
- 7. Осуществление химических реакций в открытых условиях а – в реакторе смешения; б – в реакторе вытеснения
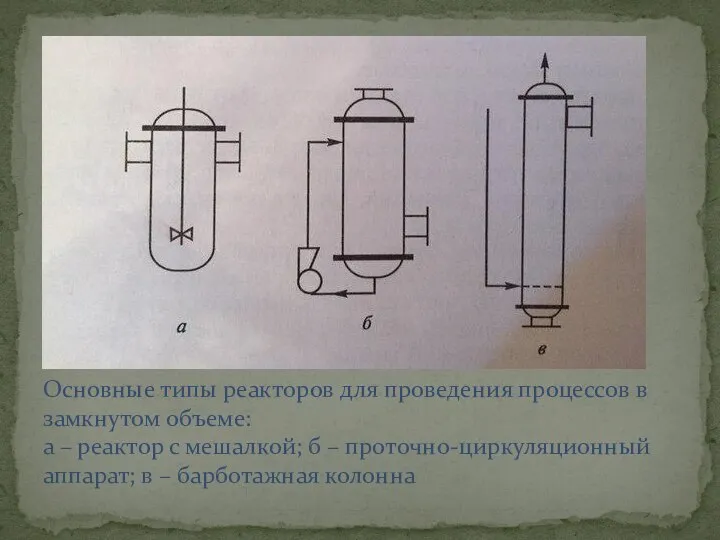
- 8. Основные типы реакторов для проведения процессов в замкнутом объеме: а – реактор с мешалкой; б –
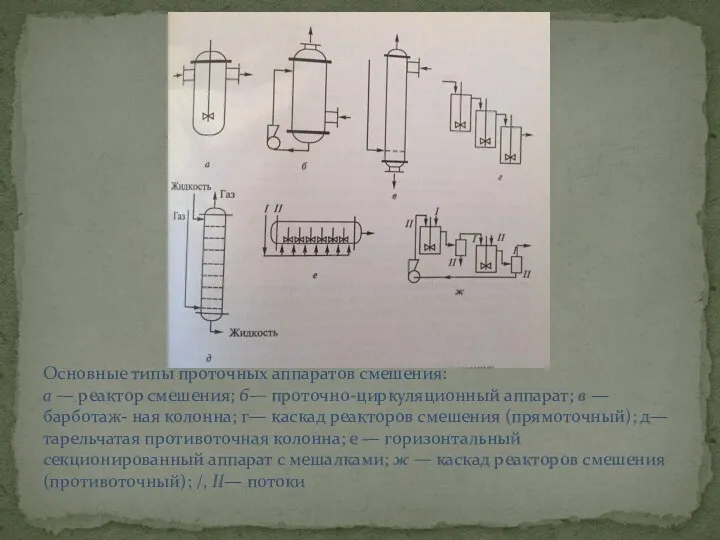
- 9. Основные типы проточных аппаратов смешения: а — реактор смешения; б— проточно-циркуляционный аппарат; в — барботаж- ная
- 10. Закономерности кинетики химических процессов существенно зависят от фазового состава системы. Поэтому различают: химические процессы, протекающие в
- 11. Основные типы процессов протекания химических реакций в реакторе
- 12. Основным законом химической кинетики является закон действующих масс Гульдберга и Вааге (1867 г.): скорость элементарной химической
- 13. Константа скорости химической реакции к зависит от температуры и природы реагирующих веществ, но не зависит от
- 14. Для нахождения молекулярности реакции часто достаточно знать коэффициенты в уравнении процесса. Однако сам процесс может складываться
- 15. Таким образом, приведенная реакция А + 2В = АВ2 является не тримолекулярной, а бимолекулярной. Как бимолекулярная
- 16. Эта реакция осуществляется в две стадии: N205 = N203 + 02 N203 + N205 = 4N02
- 17. Основное уравнение химической кинетики — закон действующих масс — дает возможность математического описания кинетики различных процессов
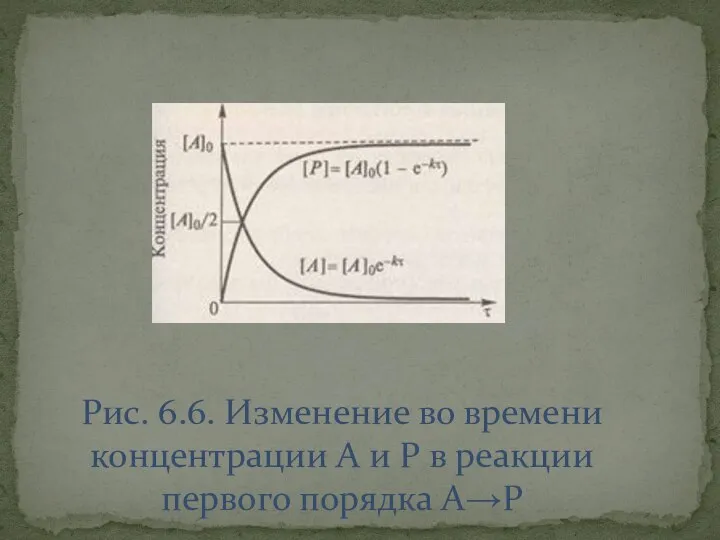
- 18. Реакция первого порядка может быть записана в общем виде: аA→продукты Примером такой реакции может служить реакция
- 19. Рис. 6.6. Изменение во времени концентрации A и P в реакции первого порядка A→P
- 20. Простая реакция второго порядка может протекать по двум кинетическим схемам: 2A → P и А1 +
- 21. d[A]/dt = -к[А]2 Интегрирование этого уравнения приводит к выражению: 1 /[А] - 1/[A]0 = 2kt. (6.3)
- 22. Константу скорости можно вычислить, подставляя экспериментальные значения [А] при разных значениях времени t в преобразованное уравнение:
- 23. Две параллельные реакции первого порядка
- 24. Реагент А превращается в Р через промежуточный продукт В. Кинетический анализ зависит от соотношения реакционной способности
- 25. 2.k1 [В] [А]0 = [А] + [В] + [Р] упрощается, так как мы можем пренебречь концентрацией
- 26. Последовательные реакции
- 28. Обратимая реакция первого порядка
- 29. Зависимость скорости реакции от температуры Важным понятием химической кинетики является скорость химической реакции. Эта величина определяет,
- 30. Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции: ,где k — константа скорости
- 32. Скачать презентацию















![d[A]/dt = -к[А]2 Интегрирование этого уравнения приводит к выражению: 1 /[А] -](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1091815/slide-20.jpg)
![Константу скорости можно вычислить, подставляя экспериментальные значения [А] при разных значениях времени](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1091815/slide-21.jpg)


![2.k1 [В] [А]0 = [А] + [В] + [Р] упрощается, так как](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1091815/slide-24.jpg)





 Презентация на тему Типы химических реакций
Презентация на тему Типы химических реакций  Электролитическая диссоциация
Электролитическая диссоциация Парфюмерные товары
Парфюмерные товары Основы химической термодинамики
Основы химической термодинамики Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Получение кислорода. Практическая работа
Получение кислорода. Практическая работа строение атома
строение атома Тест- тренажер по теме: Основные классы неорганических веществ Оксиды
Тест- тренажер по теме: Основные классы неорганических веществ Оксиды Metals Properties and compounds
Metals Properties and compounds Металлы. Строение, свойства, применение
Металлы. Строение, свойства, применение Шуточные загадки Периодической системы химических элементов
Шуточные загадки Периодической системы химических элементов Производство нитрата аммония (лекция 16)
Производство нитрата аммония (лекция 16) Презентация на тему Витамин Е
Презентация на тему Витамин Е  Пидорасня
Пидорасня Строение атома
Строение атома Типы химических реакций в неорганической химии
Типы химических реакций в неорганической химии Химический канцерогенез
Химический канцерогенез Понятия и законы в химии. (Лекция 1)
Понятия и законы в химии. (Лекция 1) Алкены-3
Алкены-3 Биохимия крови
Биохимия крови Интерактивная интеллектуальная игра юный химик
Интерактивная интеллектуальная игра юный химик Углерод и его соединения
Углерод и его соединения Дисперсные системы
Дисперсные системы Сколько нужно чистого белка
Сколько нужно чистого белка Исследование фармакологических препаратов на хлориды, методом аргентометрии
Исследование фармакологических препаратов на хлориды, методом аргентометрии Презентация на тему Строение и свойства циклоалканов
Презентация на тему Строение и свойства циклоалканов  Хлор
Хлор Викторин. Диалог химии и медицины
Викторин. Диалог химии и медицины