Слайд 3 Строение и свойства атомов
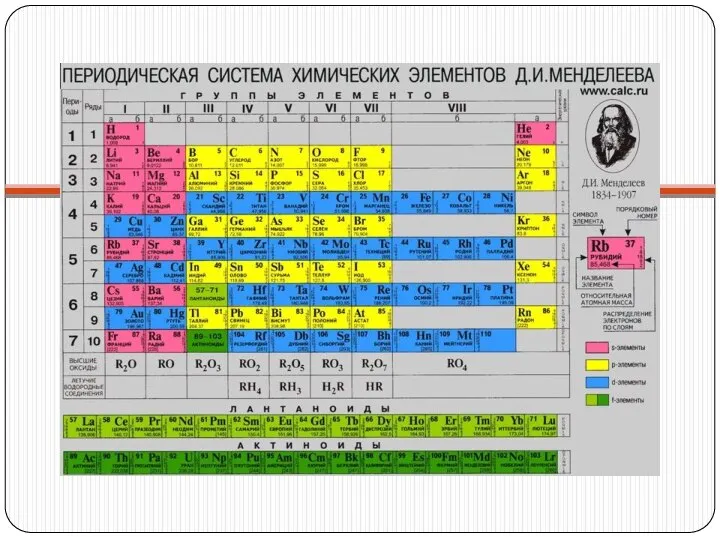
Щелочные металлы – это элементы главной подгруппы I

группы Периодической системы химических элементов Д.И. Менделеева: литий, натрий, калий, рубидий, цезий, франций.
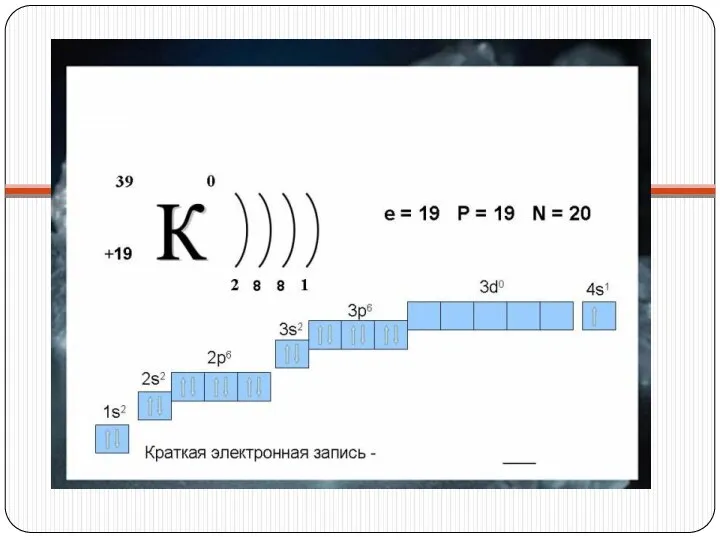
На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются сильными восстановителями. Во всех соединениях щелочные металлы проявляют степень окисления +1.
Щелочные металлы – простые вещества.
Слайд 5Физические свойства.
Серебристо – белые мягкие вещества (кроме серебристо-жёлтого цезия), с характерным блеском

на свежесрезанной поверхности. Все они лёгкие и легкоплавкие, причём, как правило, плотность их возрастает от лития к цезию. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Слайд 7Химические свойства.
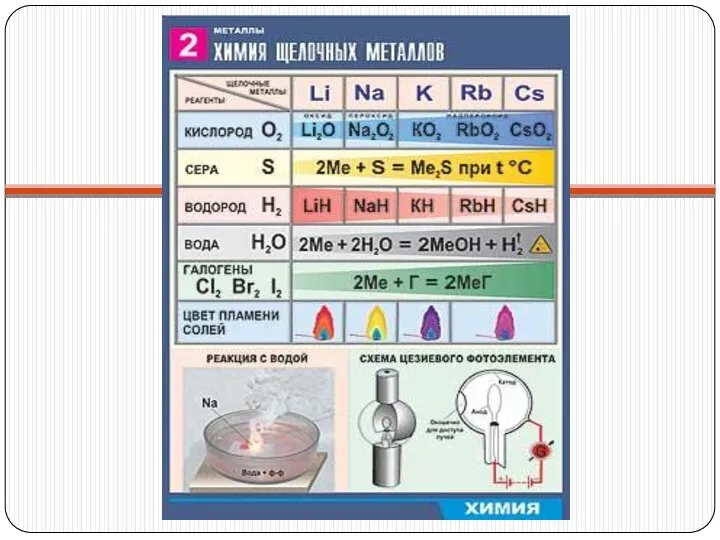
с простыми веществами:
2Li + Н2 = 2LiН – гидрид лития;
2К +

Сl2 = 2КСl – хлорид калия;
2Nа + S = Nа2S – сульфид натрия;
4 Li + О2 = 2Li2О – оксид лития.
со сложными веществами:
2Nа + 2НОН = 2NаОН + Н2
2Nа +2НСl = 2NаСl + Н2
2Nа +2СН3Сl=С2Н6+2NаСl
Слайд 9Получение.
Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще

всего — хлоридов, образующих природные минералы: 2LiCl = 2Li+Cl2
Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов: 4NaOH=4Na+2H2O+O2
Щелочной металл может быть восстановлен из соответствующего хлорида или бромида кальцием, магнием, кремнием и др. восстановителями при нагревании под вакуумом до 600-900 °C: 2MeCl+Ca=2Me+CaCl2






 Синтез и свойства кукурбитурилов
Синтез и свойства кукурбитурилов Стекло
Стекло Полімери. Пінополістирол
Полімери. Пінополістирол Учитель химии МАОУ СОШ № 61 города Тюмени Белова Н.В.
Учитель химии МАОУ СОШ № 61 города Тюмени Белова Н.В. Общая характеристика элементов главной подгруппы VI группы (подгруппы кислорода)
Общая характеристика элементов главной подгруппы VI группы (подгруппы кислорода) Растворение. Экспериментальная работа с веществами
Растворение. Экспериментальная работа с веществами Соли. Состав солей
Соли. Состав солей Типы химических реакций. Решение примеров
Типы химических реакций. Решение примеров Кислоты с металлами
Кислоты с металлами Химия. 8 класс. Подготовка к контрольной работе
Химия. 8 класс. Подготовка к контрольной работе Фосфор и его соединения
Фосфор и его соединения Пропиловый спирт C3H7OH
Пропиловый спирт C3H7OH Պոլիմերներ
Պոլիմերներ Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды Дисперсные системы
Дисперсные системы Кристаллическое состояние воды - лёд
Кристаллическое состояние воды - лёд Классификация оганических соединений. 10 класс
Классификация оганических соединений. 10 класс 20140111_mineraly
20140111_mineraly Алкены
Алкены Природные смолы: канифоль, янтарь, сандарак (2)
Природные смолы: канифоль, янтарь, сандарак (2) Жиры (липиды)
Жиры (липиды) Амины и анилин
Амины и анилин Соединения галогенов
Соединения галогенов Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Введение в органическую химию
Введение в органическую химию Активность каталазы
Активность каталазы Арены. Бензол
Арены. Бензол Основные особенности процессов растворения твёрдых веществ
Основные особенности процессов растворения твёрдых веществ