Содержание
- 2. Алкены. Олефины . Углеводороды ряда этилена. 1.Определение класса. Алкены - непредельные углеводороды , в молекулах которых
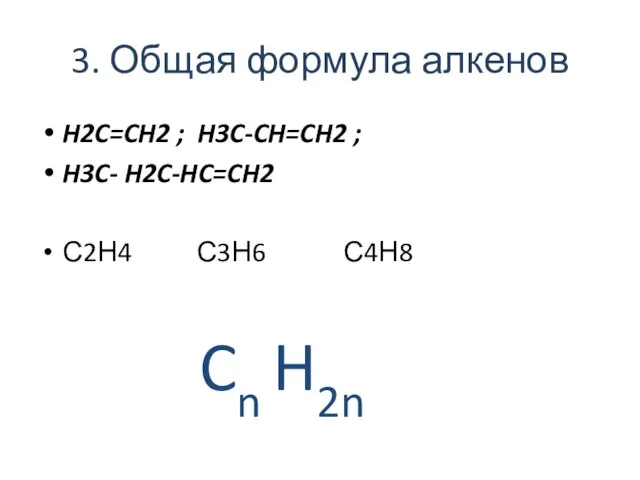
- 3. 3. Общая формула алкенов H2C=CH2 ; H3C-CH=CH2 ; H3C- H2C-HC=CH2 С2Н4 С3Н6 С4Н8 Cn H2n
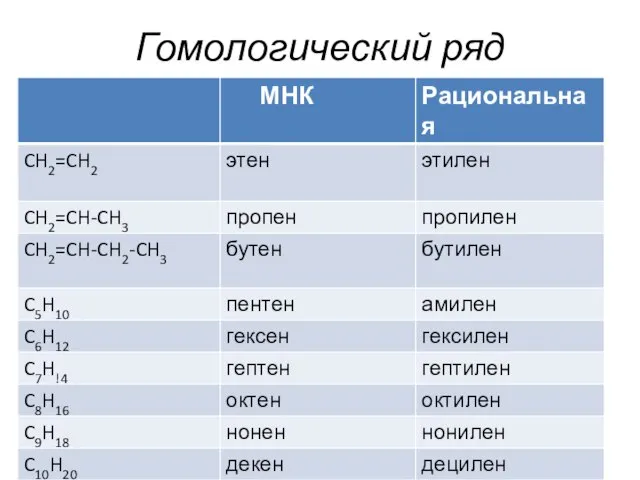
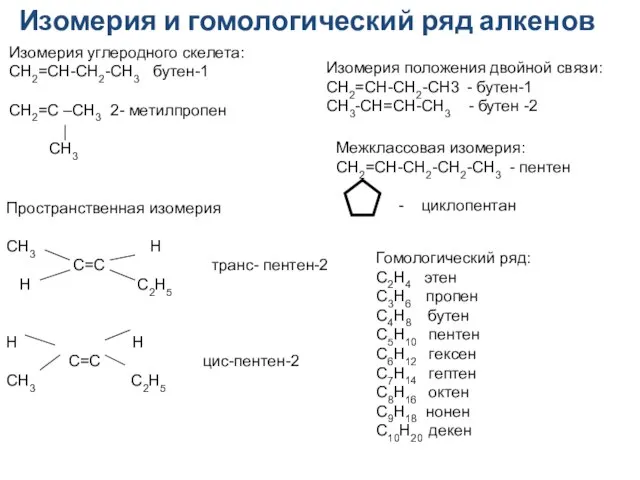
- 4. Гомологический ряд
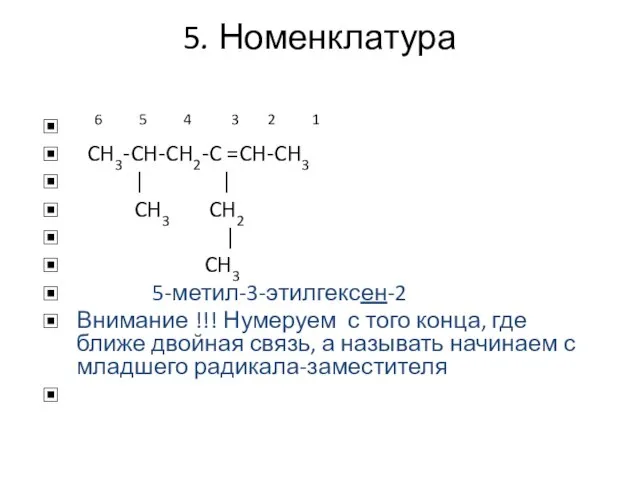
- 5. 5. Номенклатура 6 5 4 3 2 1 CH3-CH-CH2-C =CH-CH3 | | CH3 CH2 | CH3
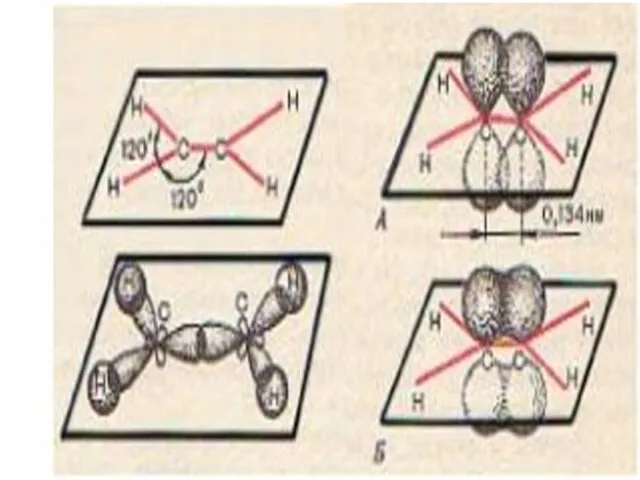
- 6. Алкены – это непредельные УВ, имеющие в строении одну двойную связь (1-σ и 1-π ). Каждая
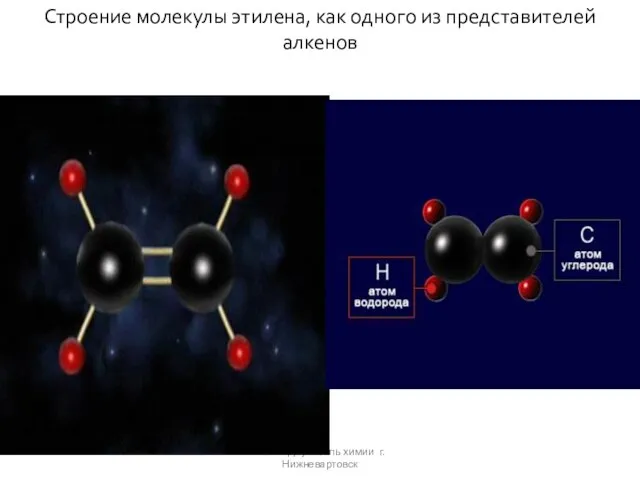
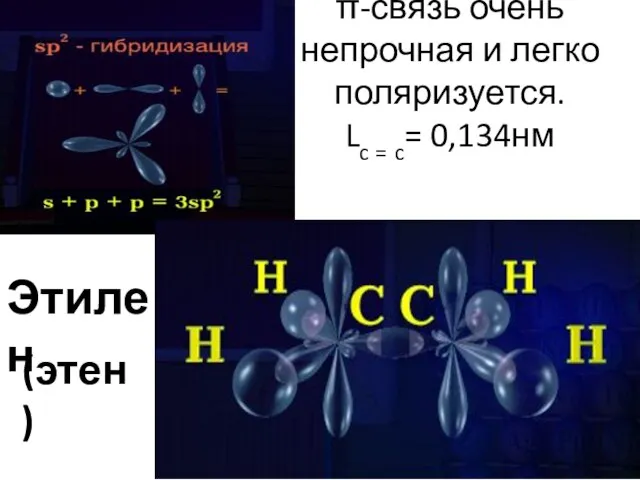
- 7. Клок Г.Д. учитель химии г.Нижневартовск Строение молекулы этилена, как одного из представителей алкенов
- 8. π-связь очень непрочная и легко поляризуется. Lc = c= 0,134нм Этилен (этен)
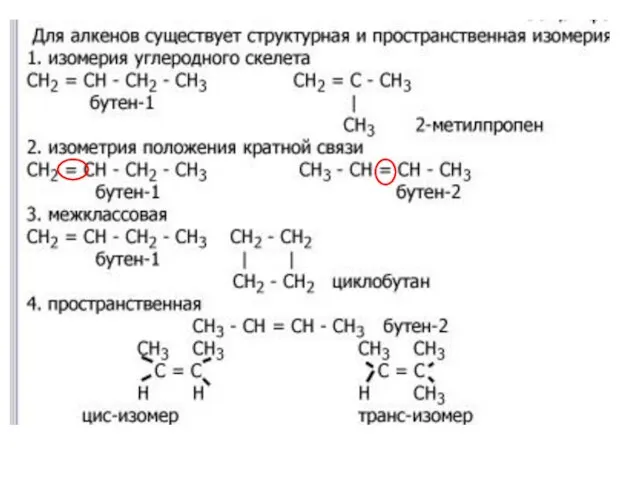
- 10. Изомерия и гомологический ряд алкенов Изомерия положения двойной связи: CH2=CH-CH2-CH3 - бутен-1 CH3-CH=CH-CH3 - бутен -2
- 12. Свойства и получение алкенов
- 13. Физические свойства С2H4 до C4H8 - газы C5 H10 до C16H32 - жидкости C17H34 и т.д.
- 14. Химические свойства : Химические свойства определяются наличием двойной связи. Х а р а к т е
- 15. Реакции присоединения: 1. гидрирование Ni 30-500C CH 3 - CH = CH2 + H2 => CH3
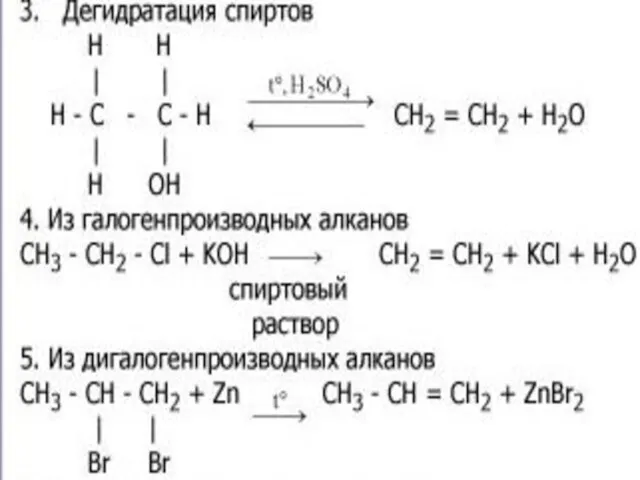
- 16. 3.реакция гидратации – присоединение воды СH2=CH2+ H2O 600 C Н2SO4 CH3 – CH2 – OH Этен
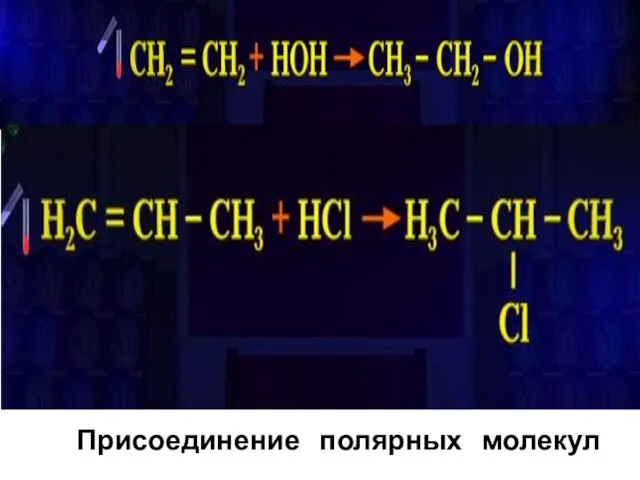
- 17. Присоединение полярных молекул
- 19. Реакции окисления мягкое окисление – характерная реакция , обесцвечивание раствора перманганата калия KMnO4 CH2 =CH2 +
- 20. Качественные реакции на этилен
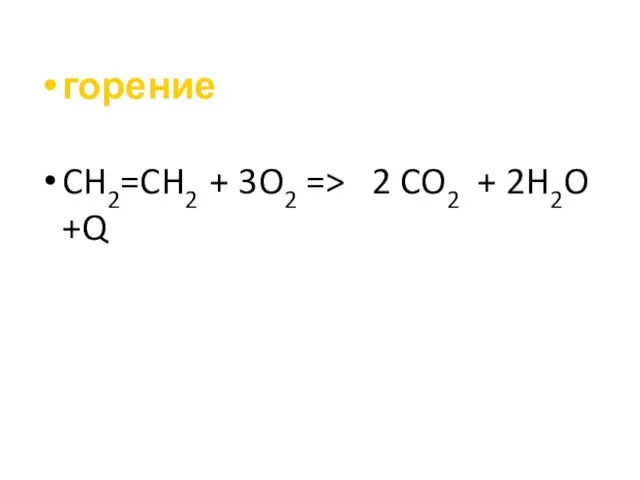
- 21. горение CH2=CH2 + 3O2 => 2 CO2 + 2H2O +Q
- 22. реакции полимеризации процесс соединения одинаковых молекул в более крупные называется п о л и м е
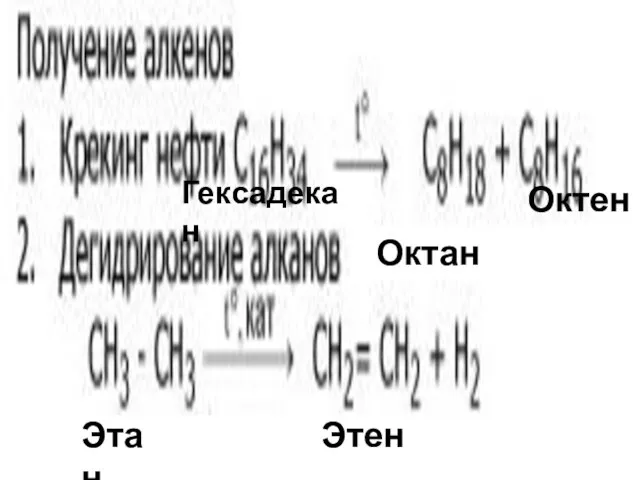
- 23. Октен Этан Этен Октан Гексадекан
- 25. Отдельный представитель -Этен или этилен а) в природе находится в небольших количествах в природном и светильном
- 27. Скачать презентацию












 Способы получения чистых веществ в лаборатории
Способы получения чистых веществ в лаборатории Плотность вещества
Плотность вещества Алкадиены. Физические свойства
Алкадиены. Физические свойства Разбор контрольной работы. Химия (9 класс)
Разбор контрольной работы. Химия (9 класс) Растворы электролитов (окончание)
Растворы электролитов (окончание) Фосфаттардағы байланыс теориясы
Фосфаттардағы байланыс теориясы Ионные уравнения реакций
Ионные уравнения реакций Презентация на тему Классы неорганических веществ
Презентация на тему Классы неорганических веществ  Благородный металл платина
Благородный металл платина Экстракционное разделение радионуклидов
Экстракционное разделение радионуклидов Презентация на тему Альдегиды и их свойства
Презентация на тему Альдегиды и их свойства  Электронное и пространственное строение молекулы метана Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ол
Электронное и пространственное строение молекулы метана Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ол Потенциодинамическая электрохимическая наногравиметрия теллура и его соединений
Потенциодинамическая электрохимическая наногравиметрия теллура и его соединений Химико-аналитический контроль
Химико-аналитический контроль Цветные реакции белков
Цветные реакции белков Хімічна промисловість
Хімічна промисловість Электролитическая диссоциация
Электролитическая диссоциация Мономеры
Мономеры Электрокинетические явления. Электрофорез. Макро- и микроэлектрофорез. Лекция 9
Электрокинетические явления. Электрофорез. Макро- и микроэлектрофорез. Лекция 9 Основания. 8 класс
Основания. 8 класс Ферсман Александр Евгеньевич Очарованный камнем
Ферсман Александр Евгеньевич Очарованный камнем Коррозия металлов, сплавов
Коррозия металлов, сплавов Строение атома
Строение атома Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Составление ионных уравнений
Составление ионных уравнений Алкоголь и мозг
Алкоголь и мозг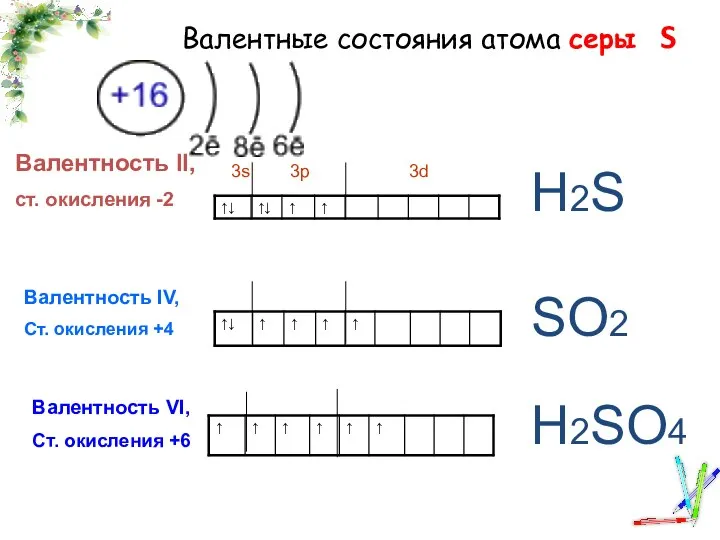 Валентные состояния атома серы
Валентные состояния атома серы Классификация химических реакций
Классификация химических реакций