Содержание
- 2. Задачи: познакомиться с типами химических связей ; научиться определять по молекулярной формуле соединения тип связей в
- 3. Что такое химическая связь? Ответ: Это взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
- 4. Различают четыре типа химических связей: Ионная связь. Ковалентная связь. Металлическая связь. Водородная связь. Рис.1
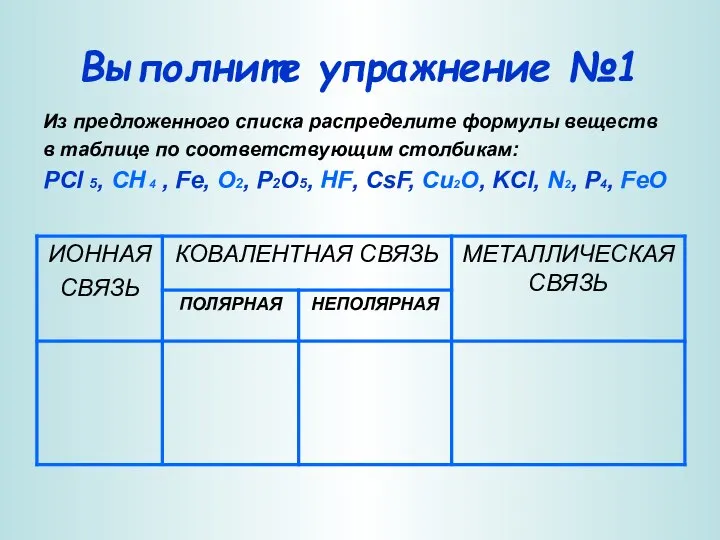
- 5. Выполните упражнение №1 Из предложенного списка распределите формулы веществ в таблице по соответствующим столбикам: PCl 5,
- 6. Выполните упражнение №2 Как меняется полярность связи в ряду: HCl – H2Se – AsH3
- 7. Выполните упражнение №3 Покажите образование ионной связи в соединениях: Cu2O, KCl.
- 8. Выполните упражнение №4 Покажите образование ковалентных связей и укажите их тип в соединениях: PCl 5, CH
- 9. Выполните упражнение №5 Определите количество σ- и π- связей в формулах молекул: SF2, SO3, H2SO4.
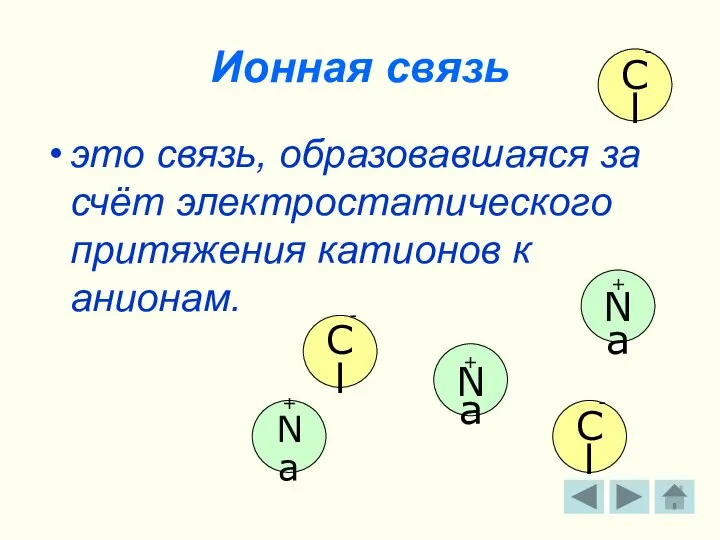
- 10. Ионная связь это связь, образовавшаяся за счёт электростатического притяжения катионов к анионам. + Na - Cl
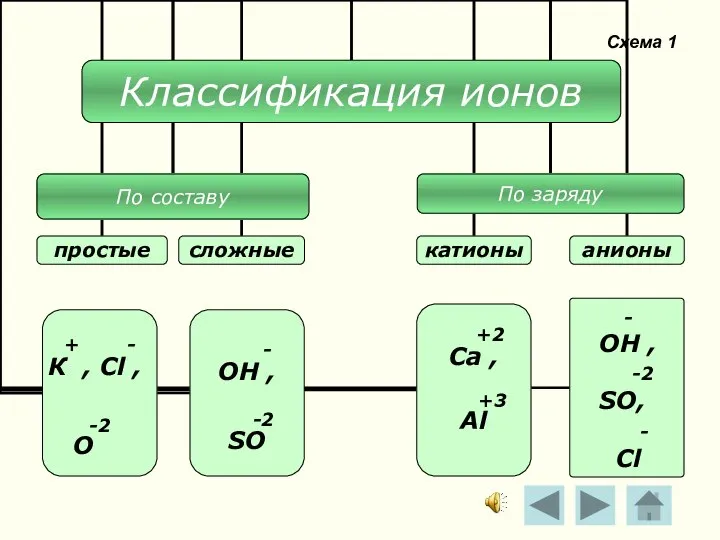
- 11. Схема 1 - ОН , -2 SO, - Cl
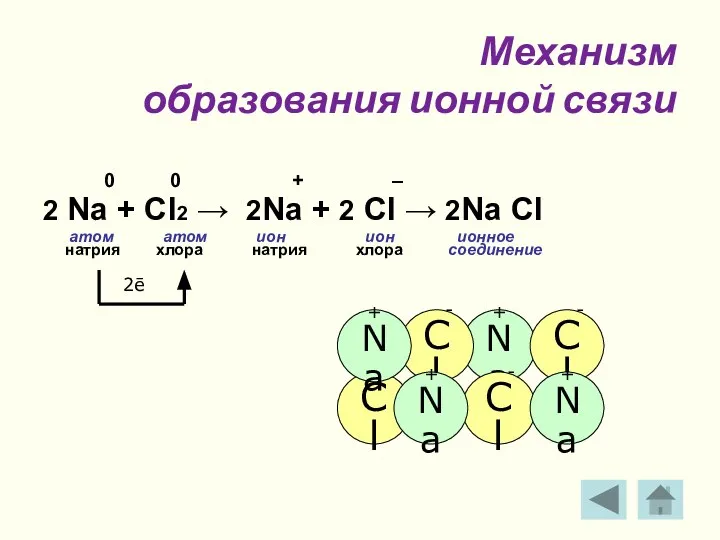
- 12. Механизм образования ионной связи 0 0 + – 2 Na + Cl2 → 2Na + 2
- 13. Ковалентная связь это связь, возникает между атомами за счёт образования общих электронных пар. ē ē ē
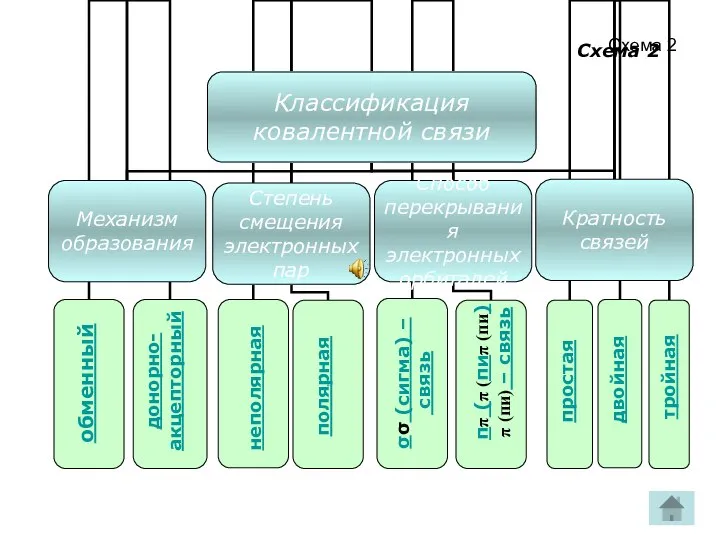
- 14. Схема 2 обменный донорно- акцепторный полярная неполярная σσ (сигма) – связь ππ (π (пиπ (пи)π (пи)
- 15. Обменный механизм образования ковалентной связи ☼ Действует, когда атомы образуют общие электронные пары за счёт объединения
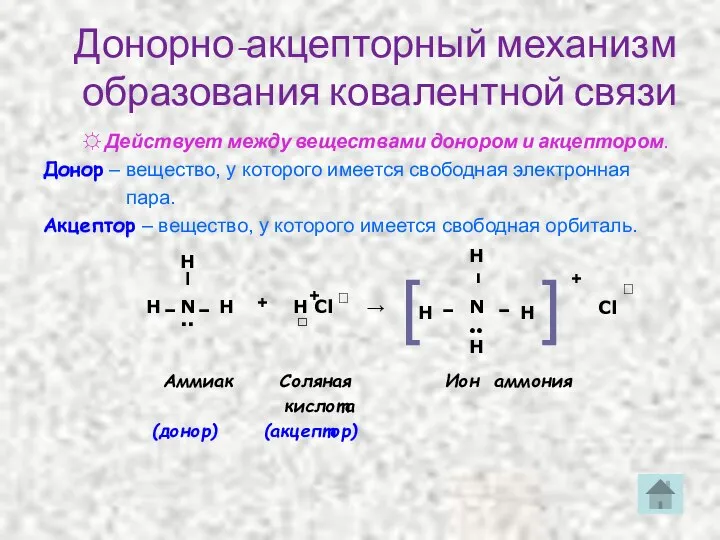
- 16. Донорно-акцепторный механизм образования ковалентной связи ☼ Действует между веществами донором и акцептором. Донор – вещество, у
- 17. Степень смещения электронных пар ☼Зависит от ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ элементов. Ряд электроотрицательности: F, O, N, C l, Br,
- 18. Кратность ковалентной связи ☼Зависит от числа общих электронных пар, связывающих атомы. Бывает: ПРОСТАЯ « - »
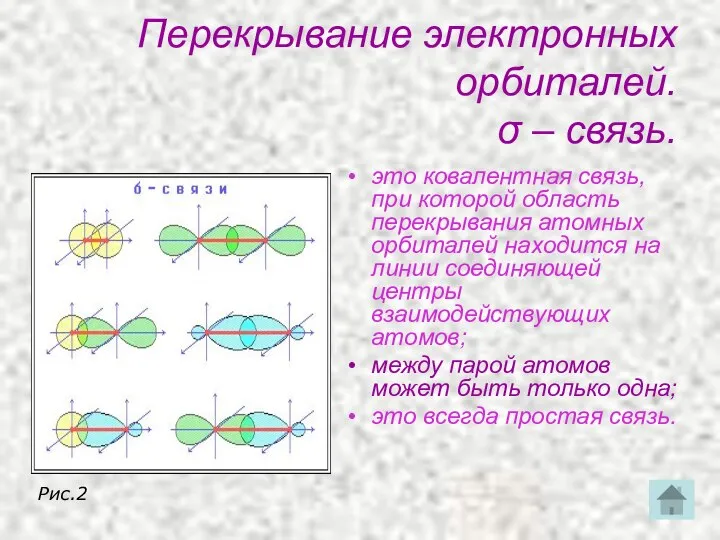
- 19. Перекрывание электронных орбиталей. σ – связь. это ковалентная связь, при которой область перекрывания атомных орбиталей находится
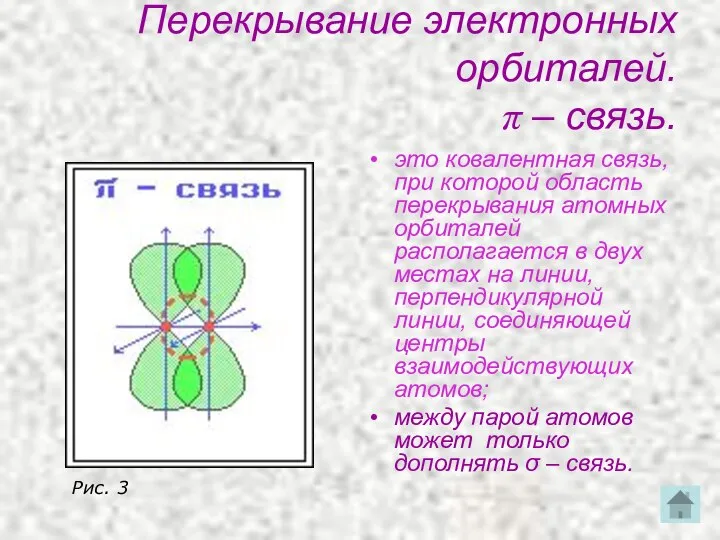
- 20. Перекрывание электронных орбиталей. π – связь. это ковалентная связь, при которой область перекрывания атомных орбиталей располагается
- 21. Металлическая связь это связь, которую осуществляют относительно свободные электроны между ионами металлов в металлической решётке. n+
- 22. Механизм образования металлической связи: 0 n+ М - nē = М Например: для элементов (металлов) Ι
- 23. Водородная связь Межмолекулярная водородная связь – это связь между атомами водорода одной молекулы и сильноотрицательными элементами(O,
- 24. Водородная связь Внутримолекулярная водородная связь – эта связь возможна при наличии в одной молекуле и электроноакцепторной
- 26. Скачать презентацию















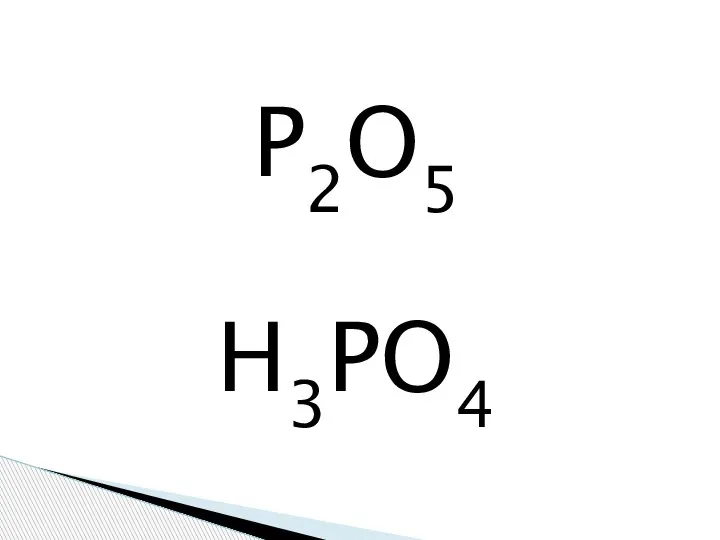 Фосфорная кислота
Фосфорная кислота Все свойства минералов
Все свойства минералов Соли как производные кислот и оснований. Цель урока: 1.Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить
Соли как производные кислот и оснований. Цель урока: 1.Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить Решение задач
Решение задач Системно-деятельностный подход в обучении химии
Системно-деятельностный подход в обучении химии Валентность и АМУ
Валентность и АМУ Углеводы. Глюкоза. 10 класс
Углеводы. Глюкоза. 10 класс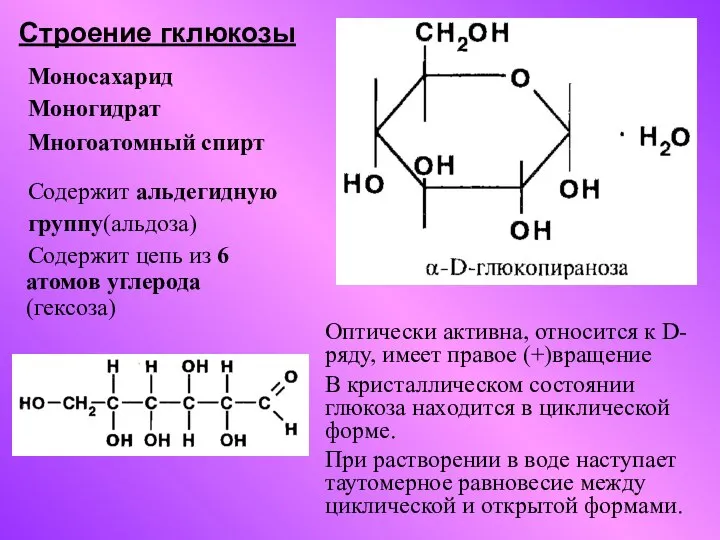 Строение гклюкозы
Строение гклюкозы Структура периодической таблицы
Структура периодической таблицы Минеральные ресурсы
Минеральные ресурсы Минералы. Определения, понятия
Минералы. Определения, понятия Удивительные кристаллы Выполнена учеником 8 а класса Савиным Анатолием Учитель: Звёздочкина С.А.
Удивительные кристаллы Выполнена учеником 8 а класса Савиным Анатолием Учитель: Звёздочкина С.А. Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения 10_KISLOTNO_OSNOVNOE_TITROVANIE
10_KISLOTNO_OSNOVNOE_TITROVANIE Спирты. Классификация спиртов
Спирты. Классификация спиртов Первоначальные химические понятия
Первоначальные химические понятия Получение меди
Получение меди Неметаллы. Общая характеристика
Неметаллы. Общая характеристика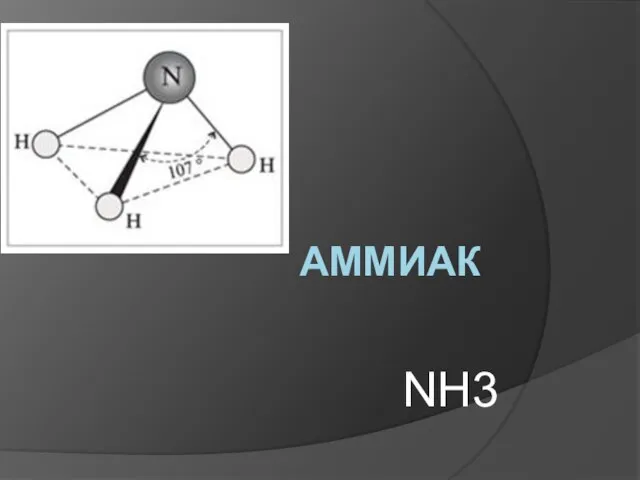 Аммиак NH3
Аммиак NH3 Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства
Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства Электролиз. Задания
Электролиз. Задания Щелочноземельные металлы
Щелочноземельные металлы Специальная обработка, химическая и радиационная обстановка
Специальная обработка, химическая и радиационная обстановка Строение вещества
Строение вещества Природные источники углеводородов
Природные источники углеводородов Подгруппа углерода
Подгруппа углерода Пищевая сода
Пищевая сода Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов
Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов