Содержание
- 2. Амфора - древний глиняный сосуд для жидких и сыпучих продуктов, c двумя вертикальными ручками и узким
- 3. Амфибии – по-русски земноводные, живущие двоякой жизнью: и на суше, и в воде, и как животные,
- 4. Амфитеатр – места для зрителей, расположенные полукругом на склонах холмов с двух сторон от артистов
- 5. Амфотерность «амфо» или «амфи» (греч.) - означает: с двух сторон; и то, и другое; это вещества,
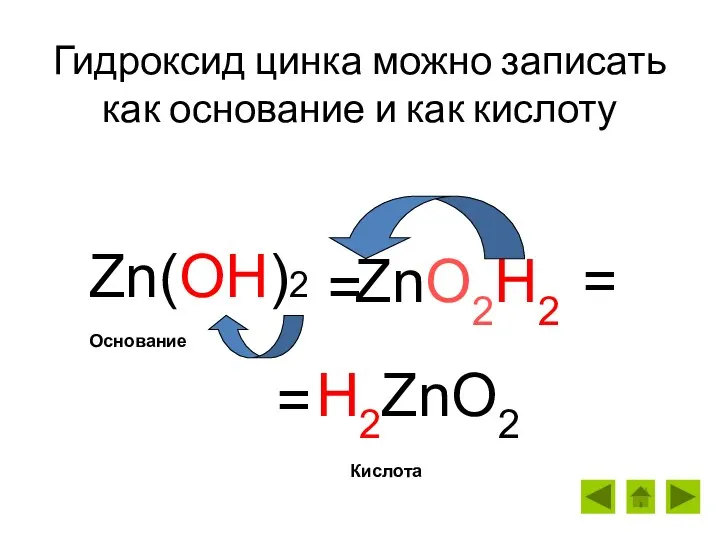
- 6. Гидроксид цинка можно записать как основание и как кислоту Zn(OH)2 = H2ZnO2 ZnO2H2 = = Кислота
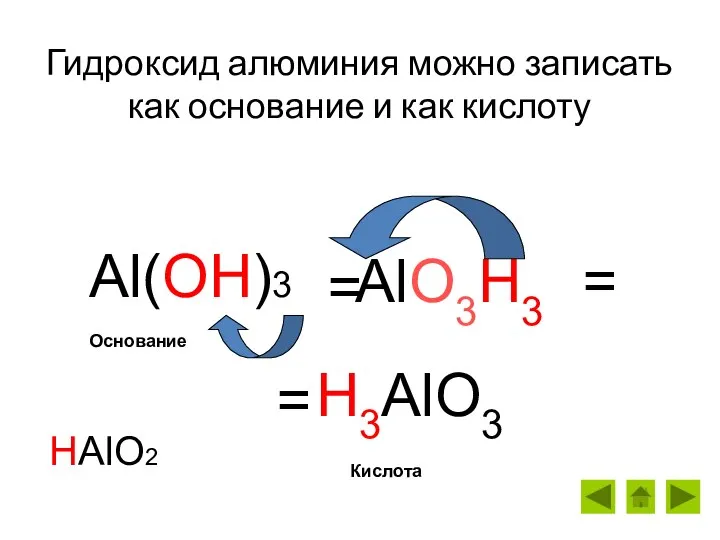
- 7. Гидроксид алюминия можно записать как основание и как кислоту Al(OH)3 = H3AlO3 AlO3H3 = = Кислота
- 8. Zn(OH)2 + HCl = H2ZnO2 + NaOH = Al(OH)3 + HCl= Al(OH)3 + NaOH= Хлорид цинка
- 9. Вывод: данные гидроксиды проявляют свойства оснований, взаимодействуя с кислотой, но они также ведут себя и как
- 10. ZnO + HCl = Al2O3+ HCl= ZnO + NaOH = Al2O3+ NaOH= Как основный Как кислотный
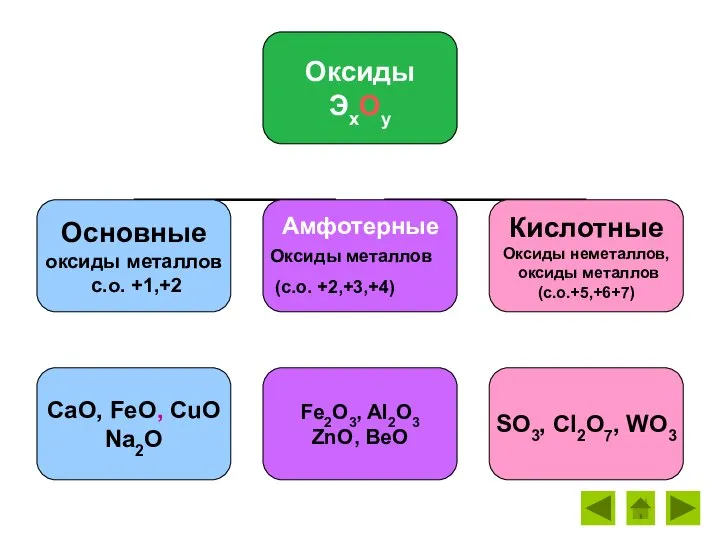
- 11. Амфотерные Оксиды металлов (с.о. +2,+3,+4)
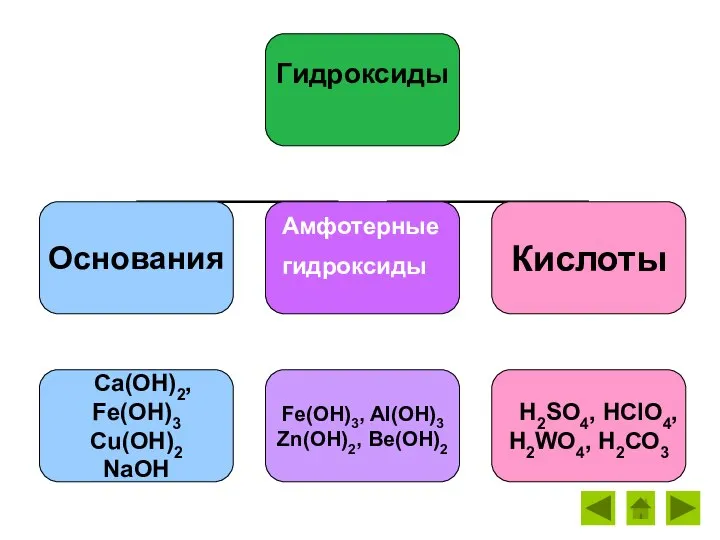
- 12. Амфотерные гидроксиды
- 13. Амфотерные оксиды (запишите в рабочей тетради!)
- 14. Амфотерные гидроксиды (запишите в рабочей тетради!)
- 15. На самом деле, взаимодействие гидроксида цинка со щелочью с образованием средней соли – цинката натрия -
- 16. Взаимодействие амфотерных соединений с растворами щелочей Al(OH)3 + КOH = К[Al(OH)4] Zn(OH)2 +NaOH= Na2[Zn(OH)4] Al2O3+KOH+H2O= ZnO+KOH+H2O=
- 17. В случае использования избытка щелочей в реакции обмена гидроксиды алюминия и цинка осаждаться не будут, поскольку
- 18. Образующиеся соли относятся к числу комплексных соединений (комплексных солей): они включают комплексные анионы [Al(OH)4]− и [Zn(OH)4]2−
- 19. ! Дополнительная информация Элементы, которые образуют амфотерные соединения – оксиды и гидроксиды, могут и сами проявлять
- 20. Вопрос 1. Как доказать амфотерность оксида или гидроксида? Провести химический эксперимент.
- 21. Вопрос 2 Можно ли варить кислые щи и хранить квашеную капусту в алюминиевой посуде? Можно ли
- 22. Вопрос 3. Отгадайте загадку: Вещество – универсал: Щелочь он парализует, Кислоту нейтрализует, И в реакции такой
- 23. Какие из групп веществ проявляют амфотерные свойства? Ca(ОН)2, Cu(ОН)2, NaОН, Fe(OН)2 Fe2O3, Al2O3, Fe(OН)3 , ZnO,
- 24. Допишите уравнение реакции: Be(OH)2 + NaOH в результате образуются Na2BeO2 + 2H2O Be(OH)2 + Na2O BeSO4
- 25. Подумайте ещё немного!
- 27. Скачать презентацию










![Взаимодействие амфотерных соединений с растворами щелочей Al(OH)3 + КOH = К[Al(OH)4] Zn(OH)2 +NaOH= Na2[Zn(OH)4] Al2O3+KOH+H2O= ZnO+KOH+H2O=](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1102406/slide-15.jpg)









 К 180-летию со дня рождения Д.И. Менделеева
К 180-летию со дня рождения Д.И. Менделеева Дисперсные системы
Дисперсные системы Химия и география. Викторина
Химия и география. Викторина Методы разделения катализаторов и продуктов, используемые для гомогенно-каталитических реакционных систем
Методы разделения катализаторов и продуктов, используемые для гомогенно-каталитических реакционных систем Бутилацетат. Химическая формула бутилацетата
Бутилацетат. Химическая формула бутилацетата строение атома
строение атома Органическая химия
Органическая химия История создания периодической таблицы
История создания периодической таблицы Исследования в химической лаборатории УГПИ
Исследования в химической лаборатории УГПИ Комплексонометрия. Способы комплексонометрического титрования
Комплексонометрия. Способы комплексонометрического титрования Нефть: состав, свойства и переработка
Нефть: состав, свойства и переработка Мицеллобразование (2)
Мицеллобразование (2) Произведение растворимости
Произведение растворимости Электролит
Электролит Кислоты. Свойства кислот
Кислоты. Свойства кислот Как вырастить кристалл
Как вырастить кристалл Тотығу - тотықсыздану реакциясы
Тотығу - тотықсыздану реакциясы Презентация на тему Щелочные металлы (9 класс)
Презентация на тему Щелочные металлы (9 класс)  Кислоты органические и неорганически
Кислоты органические и неорганически Химическая термодинамика
Химическая термодинамика Растворение веществ в воде. Лабораторный опыт № 5 Изучение растворимости веществ
Растворение веществ в воде. Лабораторный опыт № 5 Изучение растворимости веществ Галогены элементы VII – А группы
Галогены элементы VII – А группы Соли, их классификация и свойства
Соли, их классификация и свойства Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс
Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс Расчет физических свойств нефтепродуктов. Практическая работа 1
Расчет физических свойств нефтепродуктов. Практическая работа 1 Подготовка к ГИА 2021
Подготовка к ГИА 2021 Презентация на тему Карбонаты
Презентация на тему Карбонаты  Химия и производство
Химия и производство