Содержание
- 2. Кипение. Испарение = парообразование происходит со свободной поверхности жидкости при любой положительной температуре. При определенных условиях
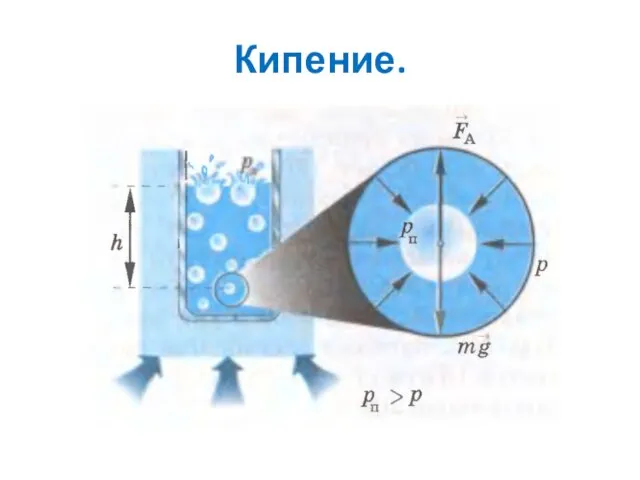
- 3. Кипение. Кипение – это парообразование во всем объеме жидкости, происходящее, при определенной температуре.
- 4. Кипение.
- 5. Кипение. Процесс: 1. В жидкости всегда есть небольшое количество воздуха в виде пузырьков, невидимых невооруженным глазом.
- 6. Кипение. Процесс: 7. Увеличение объема пузырька: когда давление насыщенного пара внутри превосходит внешнее давление 8. Если
- 7. Кипение.
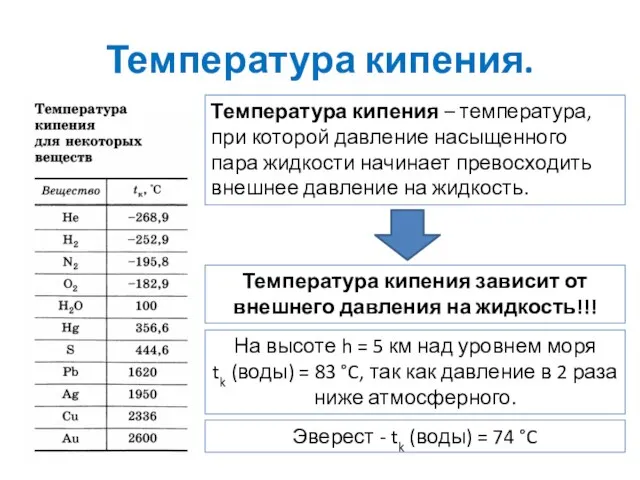
- 8. Температура кипения. Температура кипения – температура, при которой давление насыщенного пара жидкости начинает превосходить внешнее давление
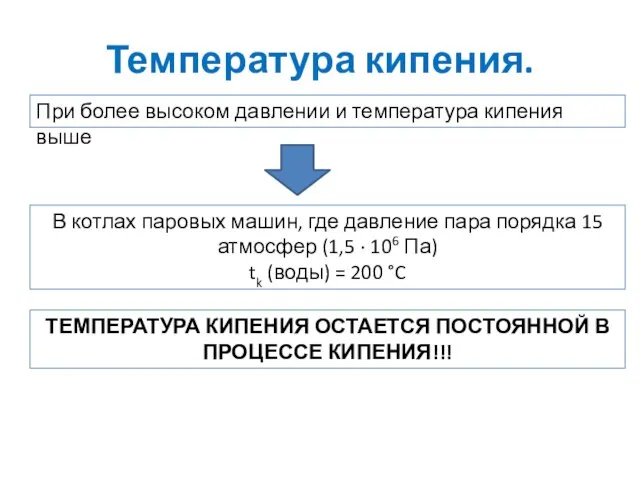
- 9. Температура кипения. При более высоком давлении и температура кипения выше В котлах паровых машин, где давление
- 10. Температура кипения.
- 11. Температура кипения. Жидкость, не содержащая газ (воздух) и находящаяся в сосуде, со стенок которого удален газ,
- 12. Температура кипения. Перегретая жидкость
- 13. Задание! Почему температура жидкости остается постоянной в процессе кипения?
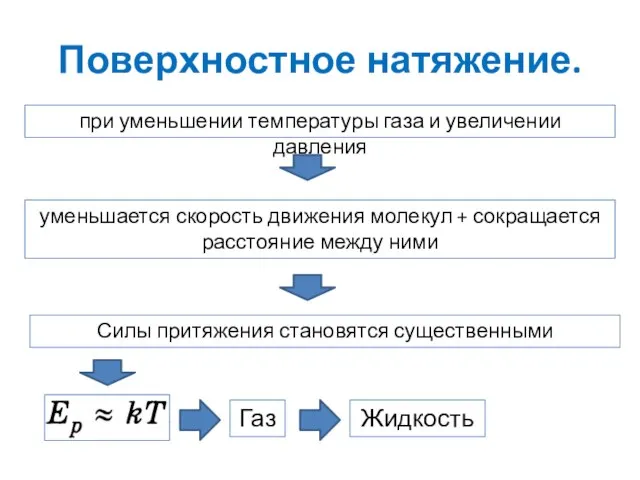
- 14. Поверхностное натяжение. Газ Жидкость при уменьшении температуры газа и увеличении давления уменьшается скорость движения молекул +
- 15. Поверхностное натяжение. Жидкость сохраняет объем Образует свободную поверхность на границе с газом (паром) Молекулы на поверхности
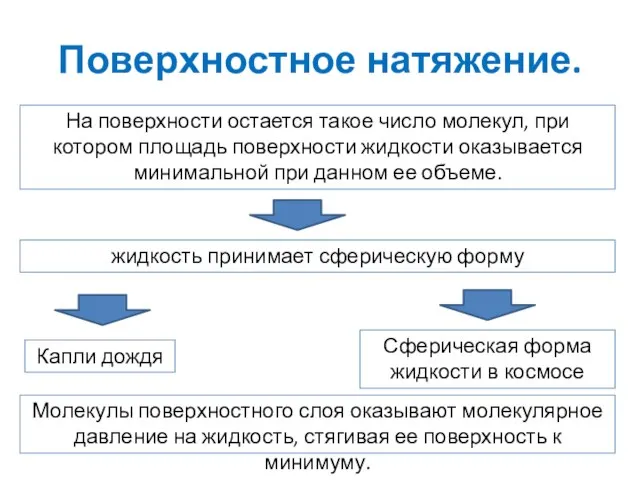
- 16. Поверхностное натяжение. На поверхности остается такое число молекул, при котором площадь поверхности жидкости оказывается минимальной при
- 17. Поверхностное натяжение. Поверхностное натяжение – явление молекулярного давления на жидкость, вызванное притяжением молекул поверхностного слоя к
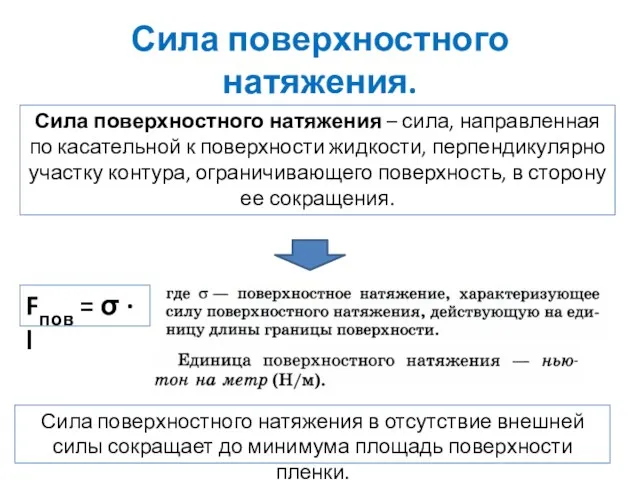
- 18. Сила поверхностного натяжения. Сила поверхностного натяжения – сила, направленная по касательной к поверхности жидкости, перпендикулярно участку
- 19. Сила поверхностного натяжения. Благодаря силе поверхностного натяжения по поверхности воды могут плавать легкие предметы и удерживаться
- 20. Сила поверхностного натяжения. Чем меньше сила поверхностного натяжения, тем легче жидкость проникает в ткань и смачивает
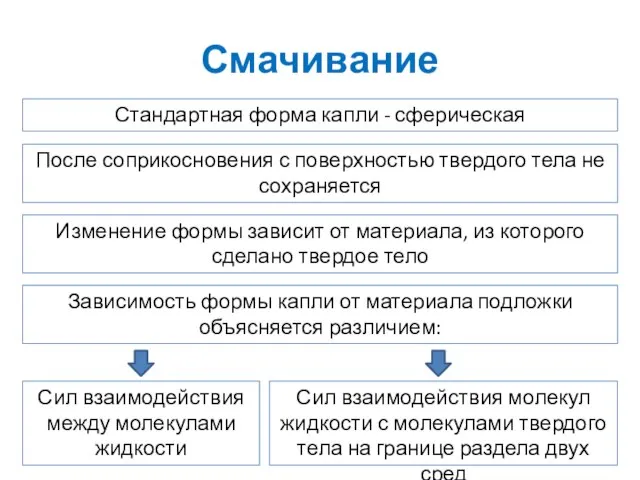
- 21. Смачивание Стандартная форма капли - сферическая После соприкосновения с поверхностью твердого тела не сохраняется Изменение формы
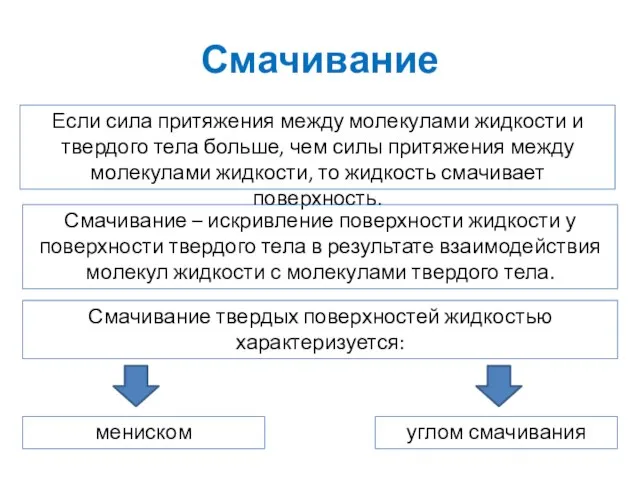
- 22. Смачивание Если сила притяжения между молекулами жидкости и твердого тела больше, чем силы притяжения между молекулами
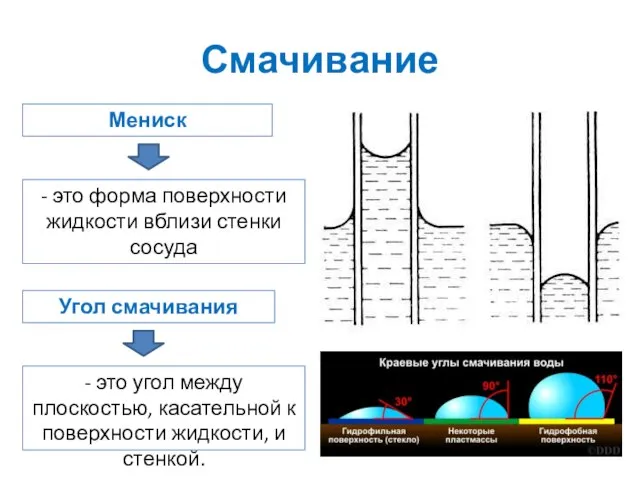
- 23. Смачивание Мениск - это форма поверхности жидкости вблизи стенки сосуда Угол смачивания - это угол между
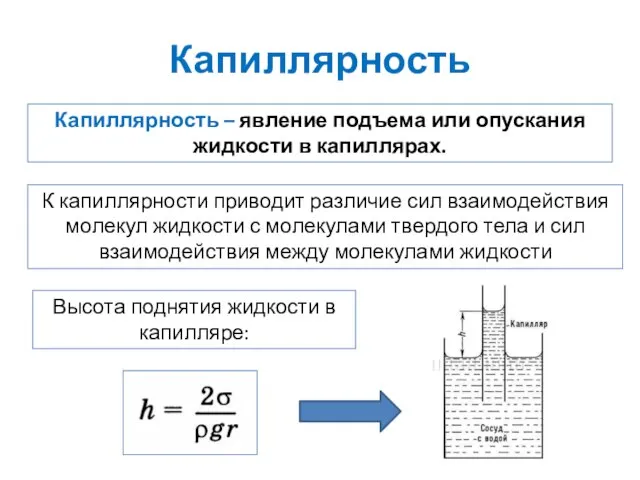
- 24. Капиллярность Капиллярность – явление подъема или опускания жидкости в капиллярах. К капиллярности приводит различие сил взаимодействия
- 26. Скачать презентацию













 Поверхность потенциальной энергии и расчет сил, действующих на ионы
Поверхность потенциальной энергии и расчет сил, действующих на ионы Идентификация С-конца ПП цепи
Идентификация С-конца ПП цепи Использование инновационных технологий в обучении химии как средство повышения подготовки специалистов
Использование инновационных технологий в обучении химии как средство повышения подготовки специалистов Презентация на тему Лабораторное оборудование. Посуда и средства защиты
Презентация на тему Лабораторное оборудование. Посуда и средства защиты  Сера. Аллотропия серы. Физические и химические свойства серы. Применение
Сера. Аллотропия серы. Физические и химические свойства серы. Применение Искусственные полимеры
Искусственные полимеры alkany
alkany Презентация на тему Полисахариды
Презентация на тему Полисахариды  Металлы и неметаллы
Металлы и неметаллы Биохимия крови
Биохимия крови Осторожно, химия
Осторожно, химия Алкены (непредельные углеводороды)
Алкены (непредельные углеводороды) Метаболизм чужеродных соединений
Метаболизм чужеродных соединений Химическое равновесие
Химическое равновесие Презентация на тему Витамины. Урок химии 10 класс
Презентация на тему Витамины. Урок химии 10 класс  Презентация на тему Растворы (11 класс)
Презентация на тему Растворы (11 класс)  Взаимодействие элементов-неметаллов между собой. 8 класс
Взаимодействие элементов-неметаллов между собой. 8 класс Презентация на тему Аммиак состав, строение, свойства, применение
Презентация на тему Аммиак состав, строение, свойства, применение  Радон (222Rn)
Радон (222Rn) Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина Биоорганическая химия
Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина Биоорганическая химия Алкины. Строение алкинов
Алкины. Строение алкинов Реакции замещения
Реакции замещения Презентация на тему Железо и его соединения
Презентация на тему Железо и его соединения  Тема урока: «Серная кислота» 9 класс
Тема урока: «Серная кислота» 9 класс Ионные уравнения
Ионные уравнения Вермикулит. Технические характеристики
Вермикулит. Технические характеристики Элементарный химический состав белков
Элементарный химический состав белков Решение задач Расчет количества протонов, нейтронов, электронов в атомах различных химических элементов.
Решение задач Расчет количества протонов, нейтронов, электронов в атомах различных химических элементов.