Содержание
- 2. План лекции 1. Общая характеристика спиртов. Классификация спиртов. 2. Гомологический ряд предельных одноатомных спиртов. Изомерия. Номенклатура.
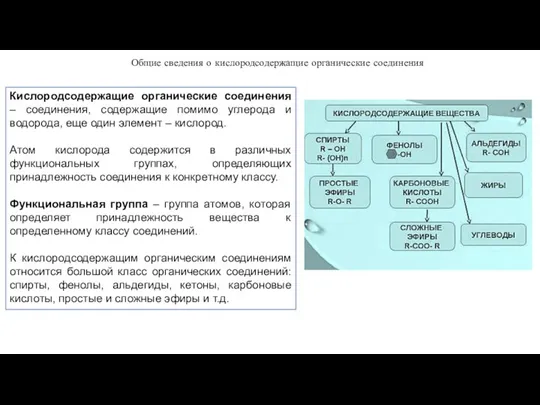
- 3. Кислородсодержащие органические соединения – соединения, содержащие помимо углерода и водорода, еще один элемент – кислород. Атом
- 4. Название этого класса происходит от латинского слова «дух вина». А с XVIII века наряду со словом
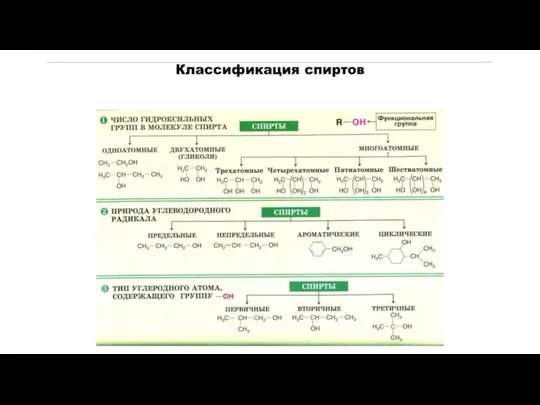
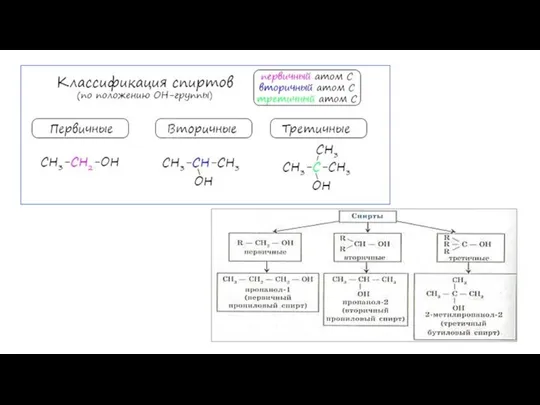
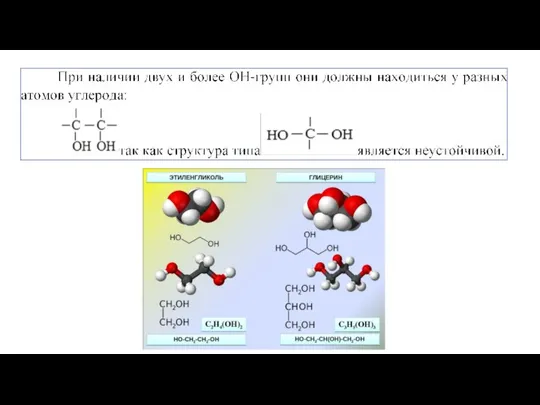
- 6. по числу гидроксильных групп (атомности) спирты
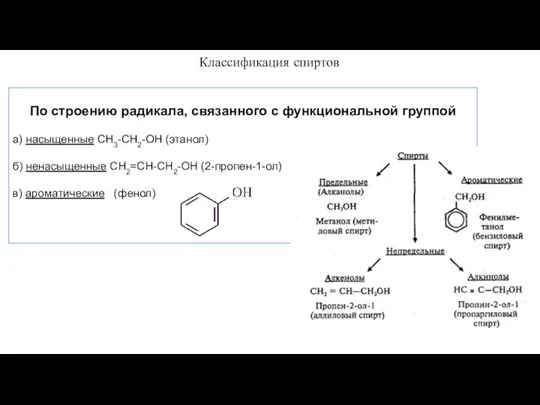
- 7. По строению радикала, связанного с функциональной группой а) насыщенные СН3-СН2-ОН (этанол) б) ненасыщенные СН2=СН-СН2-ОН (2-пропен-1-ол) в)
- 9. Общая формула – СnH2n+2O или CnH2n+1OH или R–OH, где R – углеводородный радикал . Предельные одноатомные
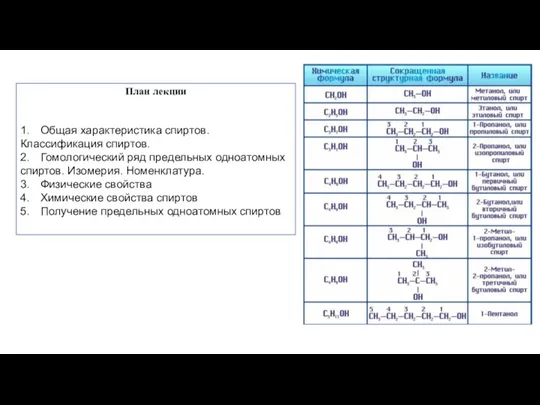
- 11. Гомологический ряд предельных одноатомных спиртов Первым членом гомологического ряда спиртов является метанол Н3С–ОН, каждый последующий член
- 12. изомерия
- 13. Номенклатура Название спиртов по заместительной номенклатуре ИЮПАК образуется от названия соответствующих алканов с добавлением суффикса -ол
- 15. В нумерации атомов углерода в главной цепи положение гидроксильной группы имеет приоритет перед положением кратных связей.
- 17. Низшие и средние члены ряда предельных одноатомных спиртов, содержащих от 1 до 11 атомов углерода, —
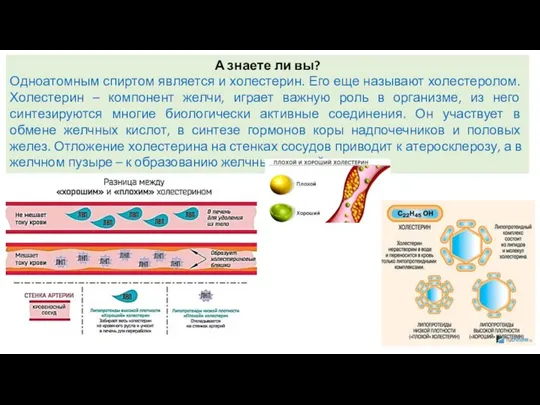
- 18. А знаете ли вы? Одноатомным спиртом является и холестерин. Его еще называют холестеролом. Холестерин – компонент
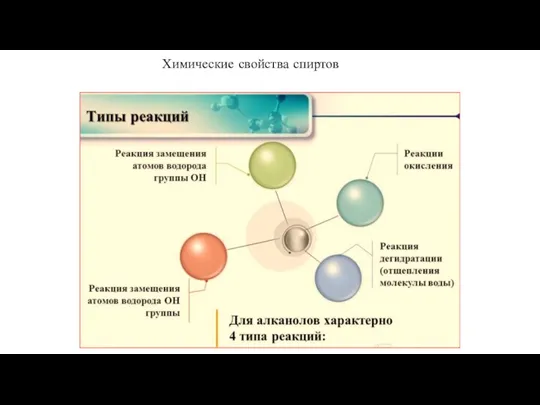
- 19. Химические свойства спиртов
- 20. Продукты замещения атома водорода гидроксильной группы спирта атомом металла называются алкоголятами.
- 21. Реакция с галогеноводородами Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула
- 22. Реакции с кислотами В результате реакций спиртов с кислотами образуются различные эфиры.
- 23. Дегидратация спиртов Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
- 24. Окисление спиртов Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции
- 25. Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В
- 26. Первичные спирты окисляются до альдегидов, а вторичные - до кетонов. Альдегиды могут быть окислены далее -
- 27. Кислотные свойства многоатомных спиртов Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами
- 28. Получение предельных одноатомных спиртов В реакциях галогеналканов со спиртовым раствором щелочи получаются - алкены, а в
- 29. Гидратация алкенов Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному
- 30. Восстановление карбонильных соединений В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.
- 31. Получение этанола брожением глюкозы В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.
- 33. Скачать презентацию






















 Щелочноземельные металлы
Щелочноземельные металлы Ионные уравнения. Кислоты, их классификация. 8 класс
Ионные уравнения. Кислоты, их классификация. 8 класс Органические вещества
Органические вещества Основания. Структурная формула
Основания. Структурная формула Презентация на тему Применение этанола и влияние его на человека
Презентация на тему Применение этанола и влияние его на человека  Тест по теме Основные классы неорганических соединений
Тест по теме Основные классы неорганических соединений Критерии оценки качества природного газа
Критерии оценки качества природного газа Роль ионов в неживой природе и в жизни людей
Роль ионов в неживой природе и в жизни людей allotropiya_fosfora_him._svoystva
allotropiya_fosfora_him._svoystva Возможные роли АФК в старении
Возможные роли АФК в старении География. Уральские самоцветы
География. Уральские самоцветы Производство концентрированной азотной кислоты (лекция 15)
Производство концентрированной азотной кислоты (лекция 15) Углеводороды. Предельные (насыщенные) углеводороды
Углеводороды. Предельные (насыщенные) углеводороды Сравнительная характеристика стиральных порошков
Сравнительная характеристика стиральных порошков Химия вокруг нас и для нас
Химия вокруг нас и для нас ATOMPP
ATOMPP Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Презентация на тему Виды химической связи
Презентация на тему Виды химической связи  Основания и их свойства
Основания и их свойства Методи визначення корозійної стійкості матеріалів (тема 11)
Методи визначення корозійної стійкості матеріалів (тема 11) Примеры реакций в жизни и в быту. Реакции по направлению процесса
Примеры реакций в жизни и в быту. Реакции по направлению процесса Презентация на тему: Чистые вещества и смеси
Презентация на тему: Чистые вещества и смеси ОГЭ №2, вопрос 1-16
ОГЭ №2, вопрос 1-16 Расчеты по химическим уравнениям реакций
Расчеты по химическим уравнениям реакций Презентация Microsoft PowerPoint
Презентация Microsoft PowerPoint Номенклатура органических соединений
Номенклатура органических соединений Понятие о химической реакции. Реакции, идущие без изменения состава веществ
Понятие о химической реакции. Реакции, идущие без изменения состава веществ Природные смолы: мирра, ладан и шеллак
Природные смолы: мирра, ладан и шеллак