Слайд 2Тема: Кислород, его общая характеристика и нахождение в природе. Получение кислорода и

его физические свойства.
Слайд 3Актуализация опорных знаний
Определенный вид атомов — ... (химический элемент).
Вещества, состоящие из

нескольких видов атомов, называются... (сложными).
Свойство атомов удерживать определенное число других атомов в соединении — ... (валентность).
Условная запись вещества, отражающая его количественный и качественный состав, называется... (химической формулой).
Вещества, образованные одним видом атомов, называются... (простыми).
Химически неделимая частица — ... (атом).
Запись химической реакции с помощью химических формул — это... (уравнение химической реакции).
«Масса веществ, вступивших в реакцию, равна массе образующихся веществ» — это формулировка... (закона сохранения массы веществ при химических реакциях).
Самое распространенное вещество на Земле —... (вода).
Явления, при которых происходит превращение одних веществ в другие, называются... (химическими).
Образование осадка, выделение газа, изменение окраски, выделение теплоты, появление запаха — все это... (признаки химической реакции).
Слайд 4Усвоение новых знаний
1. Кислород как элемент
План
характеристики химического элемента
1. Химический знак.
2. Относительная атомная

масса.
3. Валентность.
4. Распространенность элемента в природе.
Слайд 5Кислород как элемент
1. Элемент кислород находится в VI группе, главной подгруппе, II

периоде, порядковый номер №8,
Ar = 16.
2. Валентность II, степень окисления -2
(редко +2; +1; -1).
3. Входит в состав оксидов, оснований, солей, кислот, органических веществ, в том числе живых организмов.
Слайд 62. Кислород как вещество
План
характеристики простого вещества
1. Химическая формула.
2. Относительная молекулярная масса.
3. Физические свойства.
4. Химические

свойства.
5. Применение.
6. Способы получения в лаборатории и в промышленности.
7. Нахождение в природе.
Слайд 7 Историческая справка
В1774г. англичанин Джозеф Пристли (пастор по профессии, ученый по

складу ума) получил кислород и тщательно исследовал его свойства
Слайд 8О своем открытии Пристли сообщил другу - французу А. Л. Лавуазье. Тот

отличил полученный газ от обычного воздуха и дал ему название «жизненный воздух», а позже - кислород. В 1777 г. Лавуазье выпускает книгу, в которой описывает опыты по получению кислорода, и в тот же год публикуется работа шведского аптекаря Карла Шееле. Он изучал «жизненный воздух» еще в 1771-1772 гг., но из-за материальных затруднений не смог выпустить описание своих экспериментов.
Слайд 9Физические свойства кислорода.
Кислород
О2
Газ, без цвета, вкуса и запаха.
Чуть тяжелее воздуха.
Мало растворим
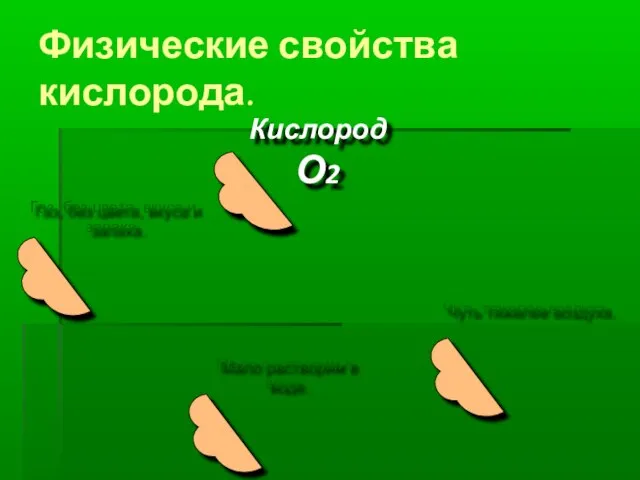
в воде.
Слайд 10Способы получения и собирания кислорода.
Кислород в природе образуется в процессе фотосинтеза.
В

промышленности
его получают перегонкой сжиженного воздуха при t = - 1830 С.
Слайд 11В лаборатории
кислород получают реакциями разложения:
а) воды под действием электрического тока (электролиз):
2H2O

→ 2H2 + O2
б) пероксида водорода под действием MnO2 :
MnO2
2Н2О2 → 2Н2О + О2
в) перманганата калия при нагревании:
2KMnO4 → K2MnO4 + MnO2 + O2
Разложение этой соли идёт при нагревании её выше 2000 С.
Слайд 12Получение кислорода , проверка его наличия тлеющей лучиной

Слайд 13Нахождение кислорода в природе
Кислород может находиться в атмосфере (21% по объему), в

земной коре (47% по массе), в живых организмах (65% по массе), в гидросфере (89% по массе). В целом 99,99% кислорода «связано» в виде соединений, 0,01% - свободное простое вещество. Кажется, что это очень небольшое количество, но на самом деле на 0,01% приходится 1,5'1015 тонн! Весь свободный кислород образуется на планете благодаря зеленым растениям. «Связывание» кислорода происходит в результате дыхания (живая природа) и горения (неживая природа).
Слайд 141. Каким символом обозначают:
а) элемент кислород,
б) атом кислорода,
в) молекулу кислорода,
д) простое вещество — кислород?
2. Какой

из химических элементов наиболее распространен в земной коре?
3. Укажите значение:
а) относительной атомной массы кислорода,
б) относительной молекулярной массы кислорода,
в) молярной массы атомов кислорода,
г) молекулярной массы кислорода.
4. Укажите, когда речь идет о кислороде как об элементе
и когда как о простом веществе:
а) чистая вода содержит 88,9% кислорода по массе;
б) воздух содержит 21 % кислорода по объему;
в) кислород входит в состав белков, жиров, углевод»
и многих других органических веществ;
г) человеку для дыхания в течение 1 часа надо 30
л кислорода,
д) атом кислорода;
е) газообразный кислород.
Слайд 15Кислород в природе
В земной коре его 49%, в воде – 89%.
В

составе воздуха (в виде простого вещества) – 20-21% по объёму.
Состав воздуха:
О2 – 20-21 %; N2 – 78%; CO2 – 0,03%,
остальное приходится на инертные газы, пары воды, примеси.
Слайд 16Домашнее задание
§ 18, 19, ответить на вопросы 1-3 стр. 59

Слайд 17Рефлексия
“Я прожил этот час не зря, потому что……

















 Значимые личности в химии
Значимые личности в химии Простые вещества в стране Химляндии. 8 класс
Простые вещества в стране Химляндии. 8 класс Порядковый номер элемента. Изотопы
Порядковый номер элемента. Изотопы Анализ воды природных источников посёлков Фруктовая и Красная Пойма городского округа Луховицы
Анализ воды природных источников посёлков Фруктовая и Красная Пойма городского округа Луховицы Предмет органической химии. Особенности органических веществ
Предмет органической химии. Особенности органических веществ Соли, их классификация и свойства
Соли, их классификация и свойства Характеристика кислорода и серы
Характеристика кислорода и серы Уравнение состояния идеального газа
Уравнение состояния идеального газа Сухой метод определения глюкозы. Глюкометры
Сухой метод определения глюкозы. Глюкометры Презентация на тему Алюминий
Презентация на тему Алюминий  Изомерия и ее виды
Изомерия и ее виды Химическая связь
Химическая связь Кремний и его соединения
Кремний и его соединения Воздух
Воздух Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов
Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов Соединения Ca и Mg, представителей элементов II группы главной подгруппы
Соединения Ca и Mg, представителей элементов II группы главной подгруппы Основные понятия в химии
Основные понятия в химии Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах
Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах Теория электролитической диссоциации. Ионные уравнения. Задания
Теория электролитической диссоциации. Ионные уравнения. Задания Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) Основы материаловедения. Раздел 1
Основы материаловедения. Раздел 1 Азот N2
Азот N2 Основи молекулярно-кінетичної теорії
Основи молекулярно-кінетичної теорії Гидролиз солей. Лекция №18
Гидролиз солей. Лекция №18 Реализация примерной адаптированной основной общеобразовательной программы по предмету Химия
Реализация примерной адаптированной основной общеобразовательной программы по предмету Химия Подготовка газа к транспорту с применением процесса низкотемпературной сепарации
Подготовка газа к транспорту с применением процесса низкотемпературной сепарации Алканы. Строение. Изомерия и номенклатура
Алканы. Строение. Изомерия и номенклатура Презентация на тему Показатели воды - её жесткость и кислотность
Презентация на тему Показатели воды - её жесткость и кислотность