Содержание
- 2. Химическое аккумулирование Химические аккумуляторы можно разделить на два типа: органические и неорганические. Термохимическое аккумулирование основано на
- 3. Водород является самым распространенным элементом на поверхности Земли, но при этом он не является источником энергии
- 4. Преимущества использование водородного аккумулятора: при сгорании водорода образуется только вода, которая может возвращаться в круговорот веществ
- 5. Недостатки: водород более взрывоопасен, чем метан, сложность хранения водорода (объемная теплота сгорания водорода в три раза
- 6. Способы получения водорода: химические, электролитические, термолитические. фотокаталитические, биохимические.
- 7. Химический способ получения водорода. частичное окисление, CH4 + 0,5O2 = CO + 2H2 2. паровая конверсия
- 8. 4. конверсия угарного газа, CO + H2O = CO2 + H2
- 9. Электролитический способ получения водорода. Преимущество – получение водорода высокой степени чистоты, в отличии от химического способа.
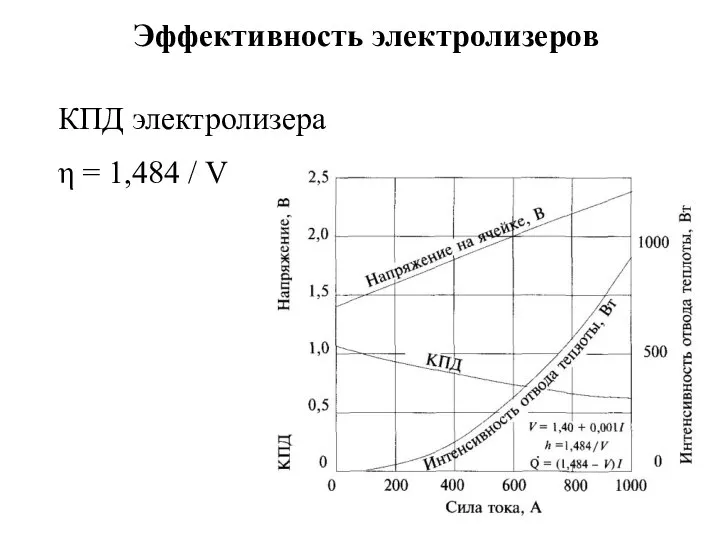
- 10. Эффективность электролизеров КПД электролизера η = 1,484 / V
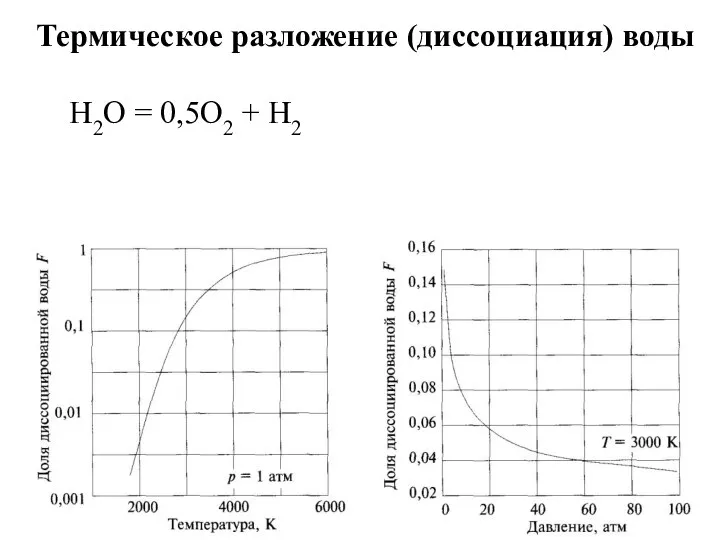
- 11. Термическое разложение (диссоциация) воды H2O = 0,5O2 + H2
- 12. Термохимическое разложение воды CaBr2 +2H2O = Ca(OH)2 + 2HBr Hg + 2HBr = HgBr2 + H2
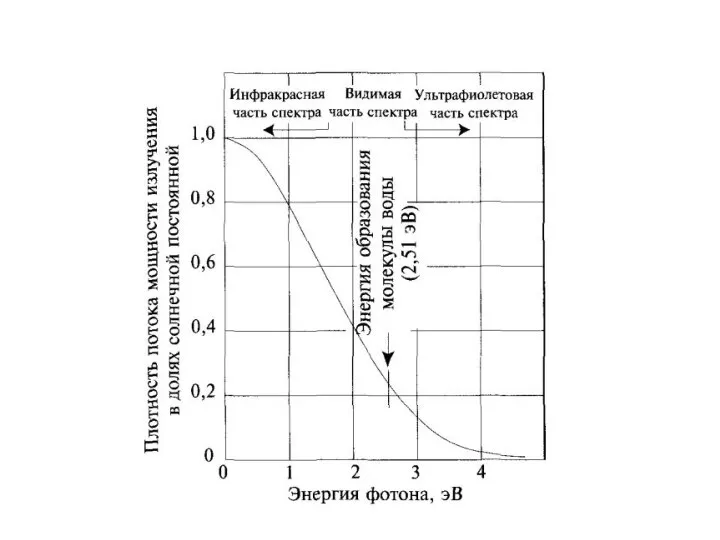
- 13. Фотокаталитическое разложение воды H
- 15. Биохимическое разложение воды Большинство растений на свету потребляют углекислый газ и выделяют кислород. Однако в темноте
- 16. Способы хранения водорода. в сжиженном состоянии (температура конденсации 20 К). в сжатом состоянии, 1. В чистом
- 17. адсорбции, соединения с сильной водородной связью (метанол, этанол и др.) в виде металлогидридов 2. В химических
- 18. массовая емкость, кг/кг объемная емкость, кг/м3 эффективность цикла, потери водорода в режиме длительного хранения. Используют следующие
- 19. В алюминиевых баллонах 150 л при давлении 500 атм вмещает 6 кг водорода (860 МДж энергии)
- 20. Для конденсации 1 кг водорода необходимо затратить около 40 МДж энергии. Плотность жидкого водорода 71 кг/м3.
- 21. Водород хорошо адсорбируется углем. Углеродные нанотрубки при температуре 120К и давлении 0,4 атм достигают массового содержания
- 22. Предъявляемые требования: Высокая емкость – плотность жидкого водорода 71 кг/м3, содержание водорода в аммиаке (NH3) –
- 23. 2. Низкая энергия образования гидрида – энергия выделяемая при сжигании водорода 143 МДж, энергия разложения аммиака
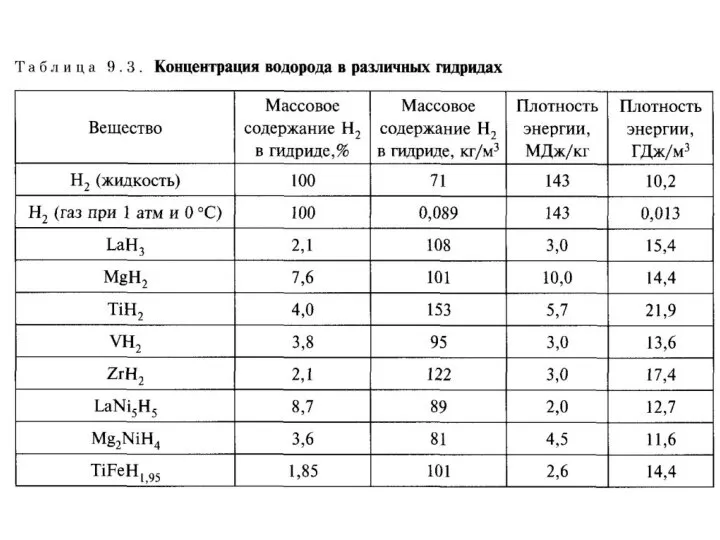
- 24. Хранение водорода в металлогидридах.
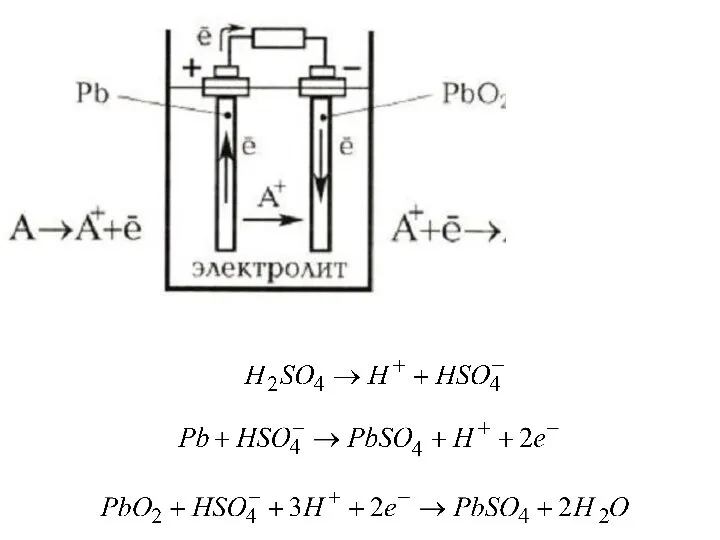
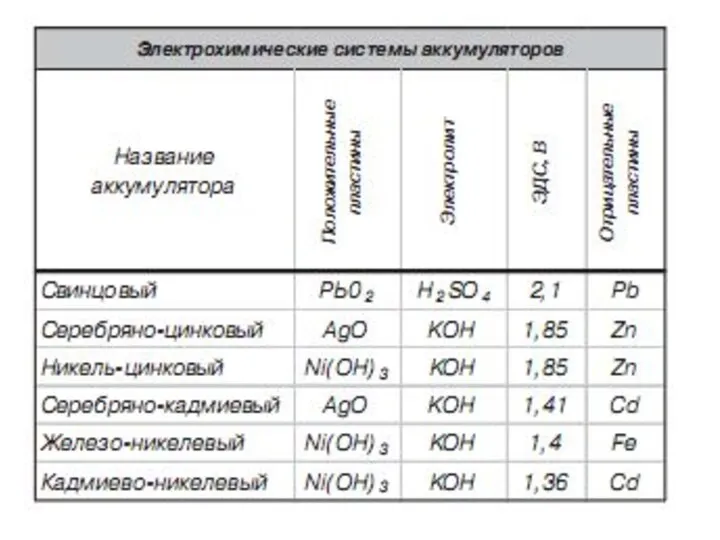
- 26. Электрохимическое аккумулирование Свинцово-кислотный аккумулятор состоит из двух пластинок-электродов (свинец и диоксид свинца), помещенных в проводящий раствор-электролит
- 28. Достоинства свинцово-кислотного аккумулятора: 1. Простота обслуживания 2. Стабильность напряжения при изменении температуры и нагрузки
- 29. Свинцово-кислотный аккумулятор имеет ряд недостатков: 1. низкая плотность энергии на единицу веса аккумулятора, (≈0,06 МДж/кг –
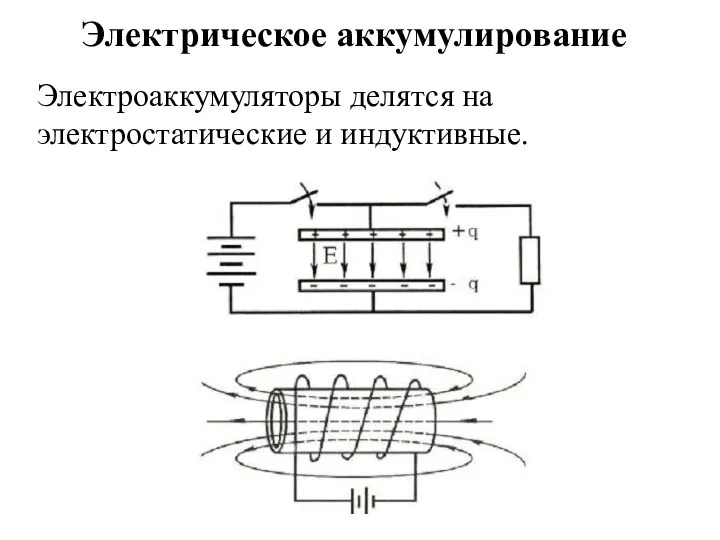
- 31. Электрическое аккумулирование Электроаккумуляторы делятся на электростатические и индуктивные.
- 32. Достоинства – простота, небольшой вес, качественная аккумулируемая энергия. Недостатки – низкая плотность энергии на единицу объема,
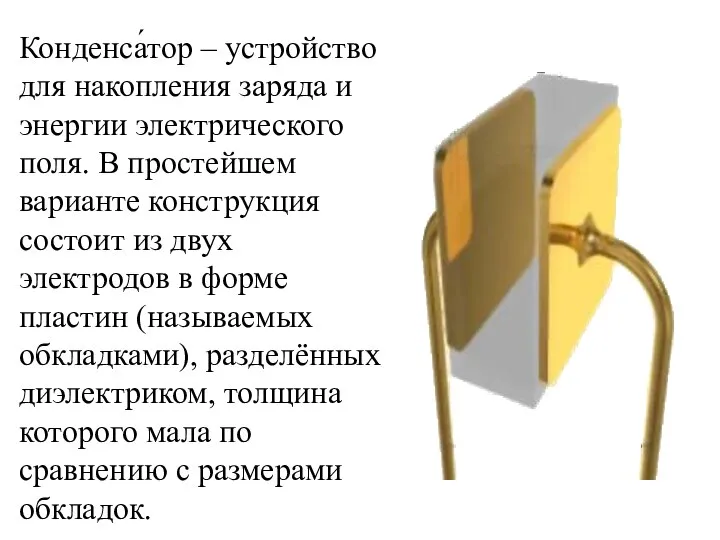
- 33. Конденса́тор – устройство для накопления заряда и энергии электрического поля. В простейшем варианте конструкция состоит из
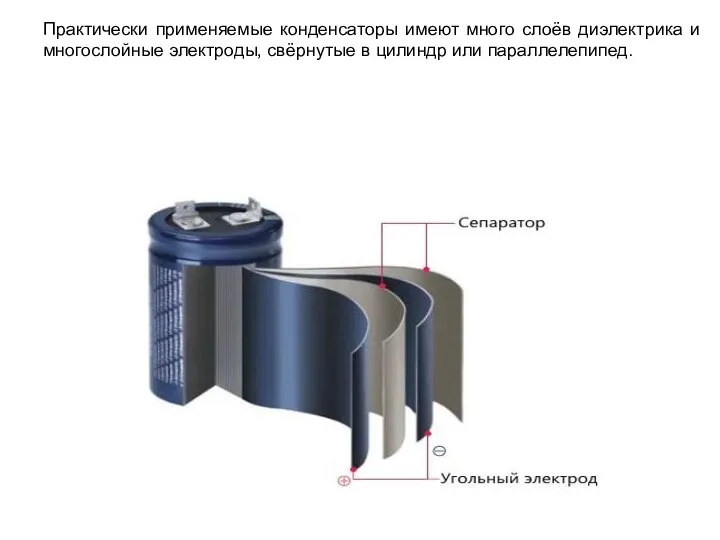
- 34. Практически применяемые конденсаторы имеют много слоёв диэлектрика и многослойные электроды, свёрнутые в цилиндр или параллелепипед.
- 35. Основная классификация конденсаторов проводится по типу диэлектрика в конденсаторе. Тип диэлектрика определяет основные электрические параметры конденсаторов:
- 36. По виду диэлектрика различают: вакуумные (между обкладками находится вакуум). 2. с газообразным диэлектриком. 3. с жидким
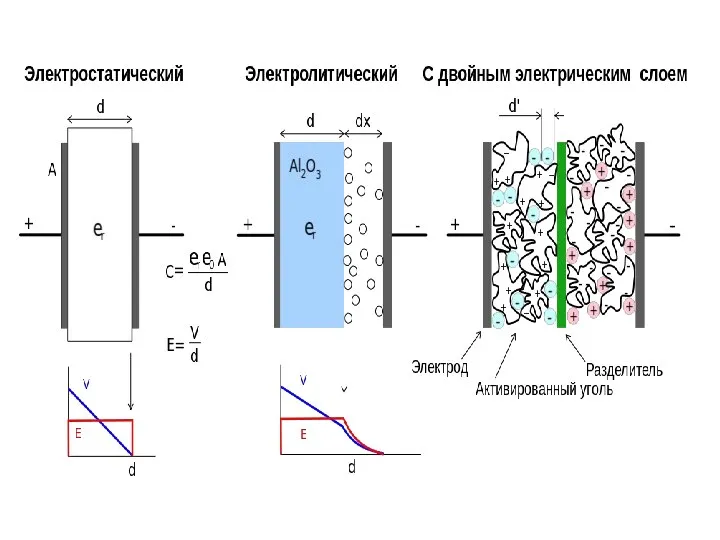
- 37. Электролитические конденсаторы отличаются от всех прочих типов большой удельной ёмкостью. В качестве диэлектрика используется оксидный слой
- 38. Суперконденсатор (электрохимический конденсатор, ионистор) – это гибрид химической аккумуляторной батареи и обычного конденсатора. Главное отличие суперконденсатора
- 40. Преимущества: 1. Большие максимальные токи зарядки и разрядки. 2. Малая деградация даже после сотен тысяч циклов
- 41. 5. Малый вес по сравнению с электролитическими конденсаторами подобной ёмкости. 6. Низкая токсичность материалов (кроме органических
- 42. Недостатки: Высокая цена ионисторов с большими разрядными токами. 2. Напряжение напрямую зависит от степени заряженности. 3.
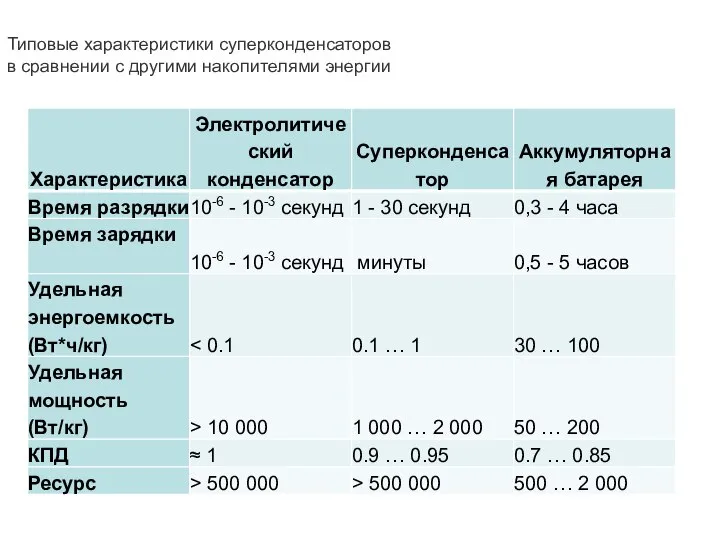
- 43. Типовые характеристики суперконденсаторов в сравнении с другими накопителями энергии
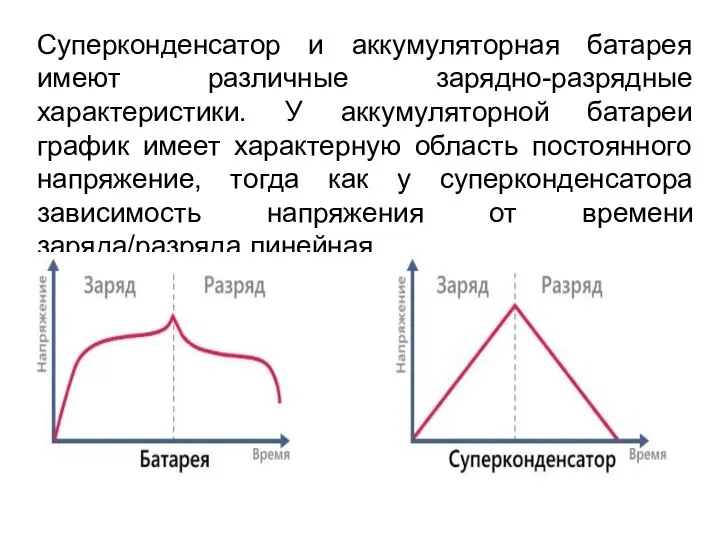
- 44. Суперконденсатор и аккумуляторная батарея имеют различные зарядно-разрядные характеристики. У аккумуляторной батареи график имеет характерную область постоянного
- 45. С мая 2017 в Минске эксплуатируют первые белорусские электробусы Белкоммунмаш Е433 Vitovt Max Electro. Электробусы "заправляются"
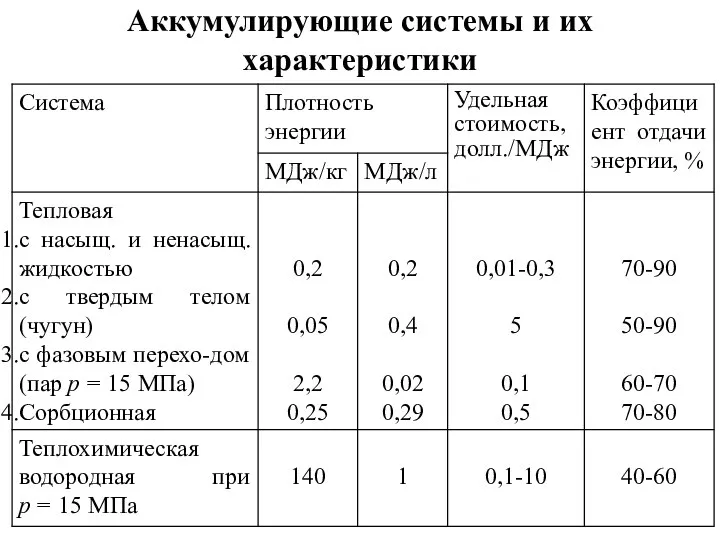
- 46. Аккумулирующие системы и их характеристики
- 48. Скачать презентацию
































 Увлекательный мир науки и практики
Увлекательный мир науки и практики Лакмусовые бумажки из сока краснокочанной капусты
Лакмусовые бумажки из сока краснокочанной капусты Распределение электронов в атомах
Распределение электронов в атомах Презентация на тему Дисперсные системы (11 класс)
Презентация на тему Дисперсные системы (11 класс)  Химическая связь
Химическая связь Аэрозоли и аэродисперсии
Аэрозоли и аэродисперсии К 180-летию со дня рождения Д.И. Менделеева
К 180-летию со дня рождения Д.И. Менделеева Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Альдегиды и кетоны
Альдегиды и кетоны Основы химической кинетики
Основы химической кинетики Альдегиды. Свойства альдегидов
Альдегиды. Свойства альдегидов Создание учебно-методических материалов по химии в современной форме (презентации уроков)
Создание учебно-методических материалов по химии в современной форме (презентации уроков) Презентация на тему Карбонаты
Презентация на тему Карбонаты  Альдегиды. Строение молекул
Альдегиды. Строение молекул Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя
Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя  Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері
Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері Оксиды. Сложные вещества
Оксиды. Сложные вещества Кальций как химический элемент
Кальций как химический элемент Использование культурологического компонента на уроках химии
Использование культурологического компонента на уроках химии Изотопы. Области применения изотопов
Изотопы. Области применения изотопов Фосфор в организме человека
Фосфор в организме человека Зависимость скорости от температуры
Зависимость скорости от температуры Легированные стали
Легированные стали Получение функциональных плёнок на основе TiO2
Получение функциональных плёнок на основе TiO2 Алюминий. 9 класс
Алюминий. 9 класс Алюминийорганические соединения
Алюминийорганические соединения Тест по химии. ГИА
Тест по химии. ГИА Химия и косметика
Химия и косметика