Содержание
- 2. Тема урока : Основания
- 3. Основаниями называются сложные неорганические соединения состоящие из атома металла и одной или нескольких гидрооксильных групп ОН
- 4. Основания Растворимые в воде -ЩЕЛОЧИ. NaOH Ba(OH) 2 Нерастворимые . Fe(OH) 3 Cu(OH) 2
- 5. Химические свойства .
- 6. Щёлочи 1.Щёлочи изменяют окраску индикаторов: Лакмус-синий Метилоранж-жёлтый Фенолфталеин-малиновый
- 7. 2.Реакция нейтрализации Ме(ОН)n +HR=H2O+MeR 2NaOH+H2SO4=Na2SO4+H2O ! Осторожно ! Едкие вещества !
- 8. Реакция между основанием и кислотой в результате которой образуется соль и вода-называется реакцией нейтрализации.
- 9. 3.Ме(ОН)n+неМеО=МеR+H2O 2Ca(OH)2+CO2=CaCO3+H2O 4.Ме(ОН)n+Me1R=MeR+Me1(OH)n Ba(OH)2+CuSO4=Cu(OH)2+BaSO4 Щёлочи разъедают кожу,ткани,бумагу. Осторожно! Смыть водой.
- 10. Нерастворимые основания . 1.Реакция нейтрализации . Ме(ОН)n+HR=MeR+H2O Fe(OH)2+H2SO4=FeSO4+2H2O
- 12. Скачать презентацию







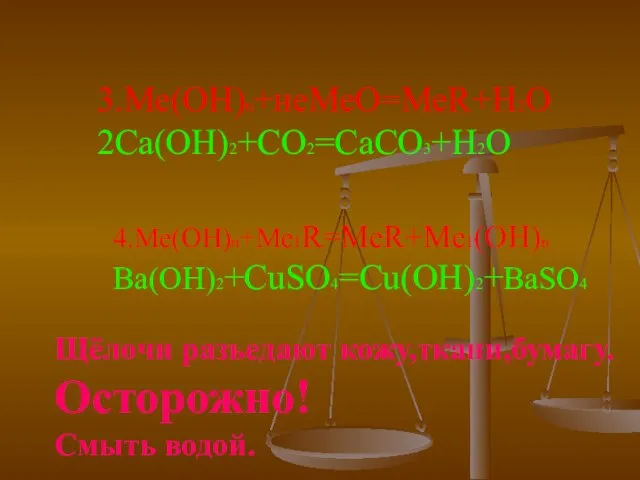

 Топливо и расчеты его горения
Топливо и расчеты его горения Задача на химическое равновесие
Задача на химическое равновесие Презентация на тему Электролиз
Презентация на тему Электролиз  Типы реакций в неорганической химии. Гидролиз. Электролиз
Типы реакций в неорганической химии. Гидролиз. Электролиз Повторение пройденного
Повторение пройденного 8-9-10 химические формулы
8-9-10 химические формулы Prezentatsia_k_uroku
Prezentatsia_k_uroku Карбоновые кислоты, их строение, номенклатура, получение и свойства
Карбоновые кислоты, их строение, номенклатура, получение и свойства Вещество. Простые и сложные вещества
Вещество. Простые и сложные вещества Методология пробoотбора с использованием ТЧЭ
Методология пробoотбора с использованием ТЧЭ Значение периодического закона для современной науки и техники (связь химии с экономикой и экологией) Учитель химии МОУ лицея
Значение периодического закона для современной науки и техники (связь химии с экономикой и экологией) Учитель химии МОУ лицея  Химическая термодинамика
Химическая термодинамика Химический опыт с горением борноэтилового эфира
Химический опыт с горением борноэтилового эфира Определение степеней окисления и расстановка коэффициентов в ОВР
Определение степеней окисления и расстановка коэффициентов в ОВР Строение атома
Строение атома Презентация на тему Свойства простых веществ
Презентация на тему Свойства простых веществ  Газообразные дисперсные системы (Аэрозоли)
Газообразные дисперсные системы (Аэрозоли) metally_mikhaylets
metally_mikhaylets Презентации 1 строение атома
Презентации 1 строение атома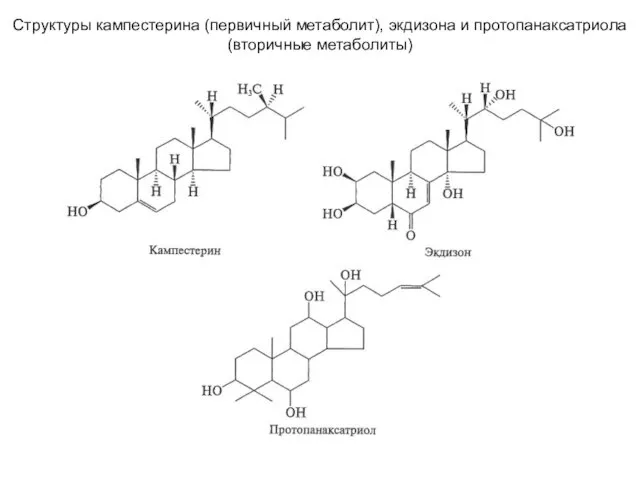 Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты)
Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты) Жиры. Техническая переработка жиров
Жиры. Техническая переработка жиров Силикатная промышленность
Силикатная промышленность Стероиды. Дицетин-холестерин-ацилтрансферазная реакция
Стероиды. Дицетин-холестерин-ацилтрансферазная реакция Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия
Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия Никель и его соединения
Никель и его соединения Презентация на тему Электронное и пространственное строение молекулы метана
Презентация на тему Электронное и пространственное строение молекулы метана  Растворы. Процесс растворения (2)
Растворы. Процесс растворения (2)