Содержание
- 2. VLASTNOSTI Už v minulosti ľudia zistili, že niektoré látky majú kyslú chuť a nazvali ich kyseliny.
- 3. VLASTNOSTI Indikátory sú napr.: lakmus metyloranž metylčerveň fenolftaleín
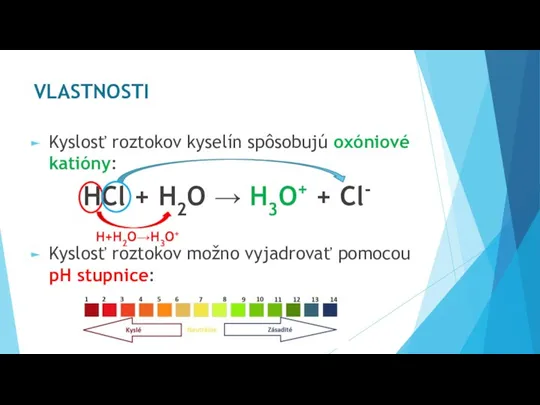
- 4. VLASTNOSTI Kyslosť roztokov kyselín spôsobujú oxóniové katióny: HCl + H2O → H3O+ + Cl- Kyslosť roztokov
- 6. KYSELINY V DOMÁCNOSTI Sú to napr.: kyselina citrónová (citrusové ovocie) kyselina octová (ocot) kyselina askorbová (=vitamín
- 7. ROZDELENIE KYSELÍN 1. BEZKYSLÍKATÉ KYSELINY sú dvojprvkové zlúčeniny vodíka a nekovového prvku, v ktorých je to
- 8. ROZDELENIE KYSELÍN 2. KYSLÍKATÉ KYSELINY sú trojprvkové zlúčeniny vodíka a nekovového prvku a kyslíka, napr: HNO3
- 9. NÁZOV je dvojslovný: podstatné meno + prídavné meno Podstatné meno = kyselina Prídavné meno = názov
- 10. má tri časti, ktoré sú uložené v poradí: napr. kyselina dusičná HI NV O-II I+V=6:2=3 HNO3
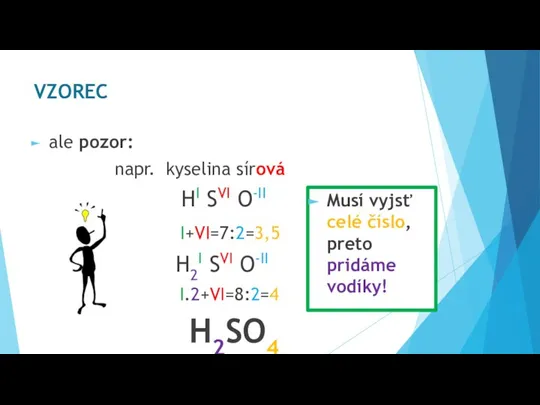
- 11. ale pozor: napr. kyselina sírová HI SVI O-II I+VI=7:2=3,5 H2I SVI O-II I.2+VI=8:2=4 H2SO4 VZOREC Musí
- 12. HaI XbI-VIII Oc-II I.a+(I-VIII).b=číslo:2=c VŠEOBECNÝ VZOREC Prečo a a b? Lebo kyselina môže obsahovať viac vodíkov
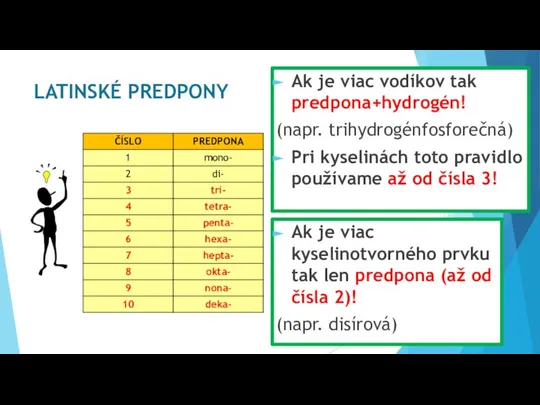
- 13. LATINSKÉ PREDPONY Ak je viac vodíkov tak predpona+hydrogén! (napr. trihydrogénfosforečná) Pri kyselinách toto pravidlo používame až
- 14. napr. kyselina trihydrogénfosforečná H3I PV O-II I.3+V=8:2=4 H3PO4 VZOREC
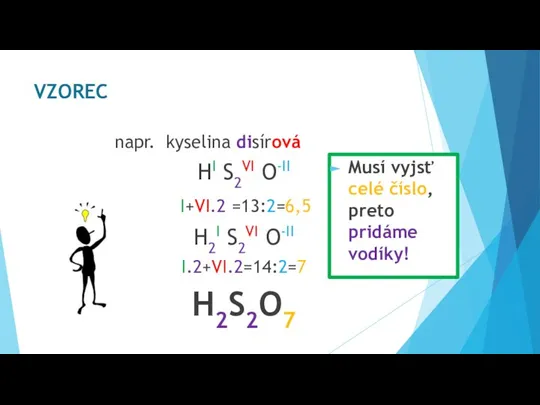
- 15. napr. kyselina disírová HI S2VI O-II I+VI.2 =13:2=6,5 H2I S2VI O-II I.2+VI.2=14:2=7 H2S2O7 VZOREC Musí vyjsť
- 16. VÝZNAMNÉ KYSELINY Kyseliny sú žieraviny, preto sa pri práci s nimi musia dodržiavať bezpečnostné opatrenia.
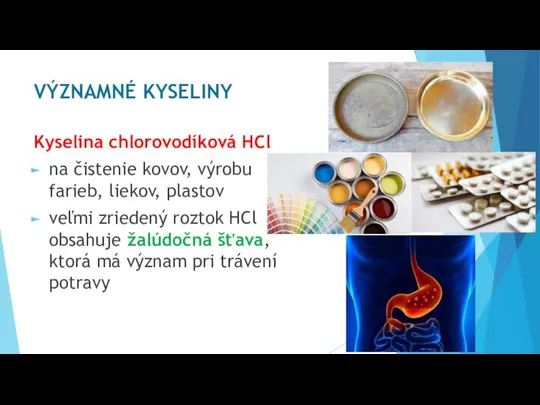
- 17. VÝZNAMNÉ KYSELINY Kyselina chlorovodíková HCl na čistenie kovov, výrobu farieb, liekov, plastov veľmi zriedený roztok HCl
- 18. VÝZNAMNÉ KYSELINY Kyselina dusičná HNO3 VÝROBA: výbušnín liekov farieb hnojív
- 20. Скачать презентацию












 Аналитические методы в современных исследованиях химии
Аналитические методы в современных исследованиях химии Презентация на тему Химия и повседневная жизнь человека
Презентация на тему Химия и повседневная жизнь человека  Вуглеводи. Визначення вуглеводів
Вуглеводи. Визначення вуглеводів Химическая связь
Химическая связь Химические реакции
Химические реакции Полиуретановые полимеры
Полиуретановые полимеры Валентность. Определение валентности химических элементов по формуле вещества
Валентность. Определение валентности химических элементов по формуле вещества Презентация на тему Аммиак
Презентация на тему Аммиак  Производство нитрата аммония (лекция 16)
Производство нитрата аммония (лекция 16) Физико - химические основы получения лекарственных препаратов (лекция 4)
Физико - химические основы получения лекарственных препаратов (лекция 4) Строение атома
Строение атома Алкины
Алкины Электронная структура атома углерода. Лекция 3
Электронная структура атома углерода. Лекция 3 Гидролиз. Виды гидролиза
Гидролиз. Виды гидролиза Полиэтилен-1
Полиэтилен-1 Строение органических молекул. (Лекция 2)
Строение органических молекул. (Лекция 2) Нефть. Её состав. Термический и каталитический крекинг
Нефть. Её состав. Термический и каталитический крекинг Углерод
Углерод Спирты. Непредельные спирты
Спирты. Непредельные спирты Окисление этанола оксидом меди
Окисление этанола оксидом меди Гідроліз солей
Гідроліз солей Изотопная геохимия. Лекция 4-5
Изотопная геохимия. Лекция 4-5 Элементоорганические мономеры (соединения)
Элементоорганические мономеры (соединения) Относительная атомная масса. Массы атомов
Относительная атомная масса. Массы атомов Выращивание кристаллов
Выращивание кристаллов Классификация спиртов. Изомерия спиртов
Классификация спиртов. Изомерия спиртов Кремний и его соединения. Силикатная промышленность
Кремний и его соединения. Силикатная промышленность Характеристика химического элемента по его положению в периодической системе элементов Д.И. Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д.И. Менделеева