Содержание
- 2. ЦЕЛИ : Повторить и закрепить знания о строении атома и молекулы азота. Изучить физические и химические
- 3. ДЕВИЗ УРОКА : «Нет жизни без азота, ибо он является непременной составной частью белков.» Д.Н.Прянишников
- 4. ИСТОРИЯ ОТКРЫТИЯ К.Шееле и Г.Кавендиш получили азот 1772г. Д.Резерфорд описал получение и свойства 1787г. Лавуазье предложил
- 5. НАХОЖДЕНИЕ В ПРИРОДЕ: 1)В СВОБОДНОМ СОСТОЯНИИ В АТМОСФЕРЕ (78%), 2)В СВЯЗАННОМ СОСТОЯНИИ (СМОТРИ ТАБЛИЦУ)
- 6. СТРОЕНИЕ И СВОЙСТВА АТОМА 2 период, 5 группа, главная подгруппа Содержит на внешнем энергетическом уровне 5
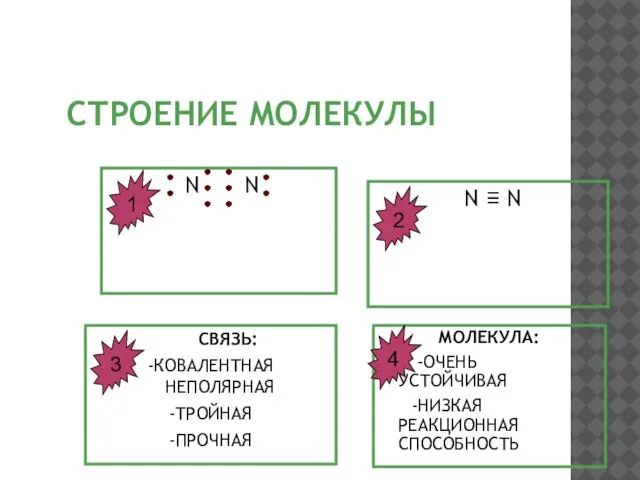
- 7. СТРОЕНИЕ МОЛЕКУЛЫ N N N ≡ N СВЯЗЬ: -КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ -ТРОЙНАЯ -ПРОЧНАЯ МОЛЕКУЛА: -ОЧЕНЬ УСТОЙЧИВАЯ -НИЗКАЯ
- 8. ФИЗИЧЕСКИЕ СВОЙСТВА. Газ без цвета, запаха и вкуса Плохо растворим в воде Немного легче воздуха, плотность
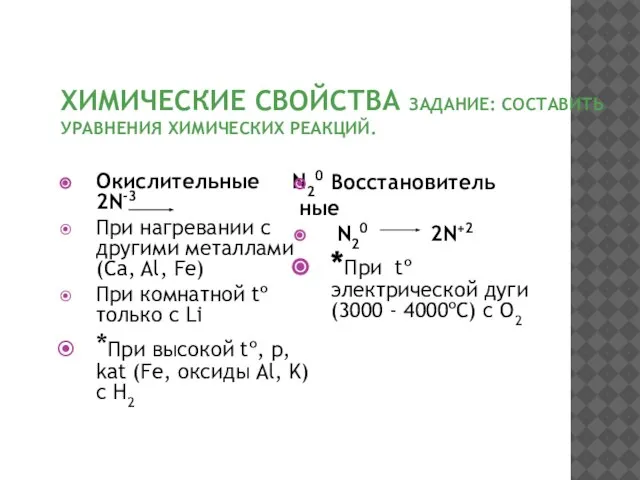
- 9. ХИМИЧЕСКИЕ СВОЙСТВА ЗАДАНИЕ: СОСТАВИТЬ УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ. Окислительные N20 2N-3 При нагревании с другими металлами(Ca, Al,
- 10. ПРИМЕНЕНИЕ АЗОТА Применение Получение аммиака и азотной кислоты. Создание инертной атмосферы в металлургии. Производство азотных удобрений.
- 11. ПОЛУЧЕНИЕ АЗОТА Получение В промышленности – из жидкого воздуха В лаборатории – разложением неустойчивых соединений азота
- 12. Закрепление нового материала
- 13. Рефлексия (работа в парах) Название темы – одно существительное Описание темы – два прилагательных Описание действия
- 15. Скачать презентацию









 Золото
Золото Круговорот серы в природе
Круговорот серы в природе Аварийно-химически опасное вещество (АХОВ)
Аварийно-химически опасное вещество (АХОВ) Презентация на тему Интересные факты из жизни Д. И. Менделеева
Презентация на тему Интересные факты из жизни Д. И. Менделеева  Характеристика кислорода как химического элемента и простого вещества
Характеристика кислорода как химического элемента и простого вещества Alkini
Alkini Предмет химии. Вещества
Предмет химии. Вещества Органическая химия. Введение
Органическая химия. Введение Химические средства защиты растений
Химические средства защиты растений Циклоалканы. Физические свойства
Циклоалканы. Физические свойства Метод проекта на уроках химии и биологии и внеурочное время
Метод проекта на уроках химии и биологии и внеурочное время Лекция № 1
Лекция № 1 Pomalé a rýchle reakcie v bežnom živote
Pomalé a rýchle reakcie v bežnom živote Бензол (Арены )
Бензол (Арены ) Германий, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение
Германий, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение Состав и строение атома. Изотопы
Состав и строение атома. Изотопы Способы очистки питьевой воды
Способы очистки питьевой воды Ориентация полимеров
Ориентация полимеров Жидкокристаллический эластомер как роторный актуатор
Жидкокристаллический эластомер как роторный актуатор Исследование структуры продуктов аммонолиза мезопористых магниетермических порошков тантала
Исследование структуры продуктов аммонолиза мезопористых магниетермических порошков тантала Круговорот азота в природе
Круговорот азота в природе Углеводороды: изомерия
Углеводороды: изомерия Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Химическая школа ДПИ НГТУ
Химическая школа ДПИ НГТУ Магний - активный, но под защитой
Магний - активный, но под защитой Мицеллобразование (2)
Мицеллобразование (2) Презентация на тему по химии витамины
Презентация на тему по химии витамины  Презентация по Химии "Химические свойства галогенов"
Презентация по Химии "Химические свойства галогенов"