Германий, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение
Содержание
- 2. Германий (лат. Germanium) - химический элемент IV группы периодической системы Д.И. Менделеева, относится к семейству металлов.
- 3. Существование и свойства Германия предсказал в 1871 году Д.И. Менделеев и назвал этот неизвестный еще элемент
- 4. Аргиродит Ag8GeS6 Германит Cu26Ge4Fe4S32 Германий концентрируется в месторождениях многих металлов — в сульфидных рудах цветных металлов,
- 5. Оксид GeO – темно – серый порошок, плохо растворим в воде и легко – в кислотах
- 6. Синтез органических производных германия осуществляют, исходя из металлического германия и его неорганических соединений – диоксида GeO2,
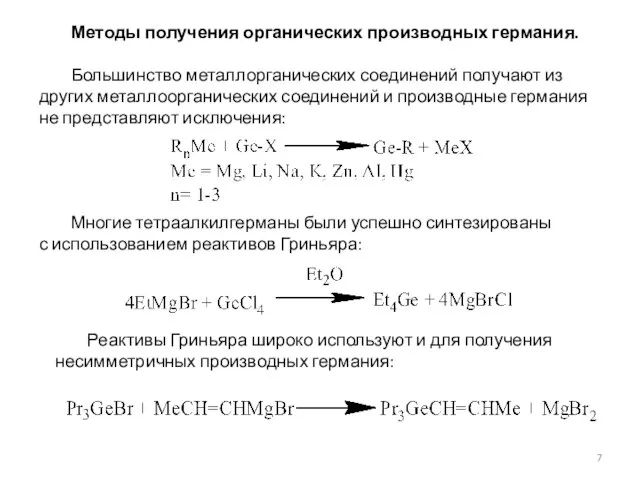
- 7. Методы получения органических производных германия. Большинство металлорганических соединений получают из других металлоорганических соединений и производные германия
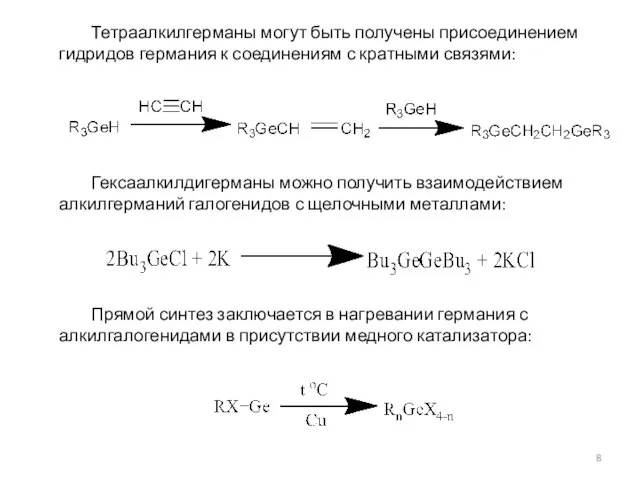
- 8. Тетраалкилгерманы могут быть получены присоединением гидридов германия к соединениям с кратными связями: Гексаалкилдигерманы можно получить взаимодействием
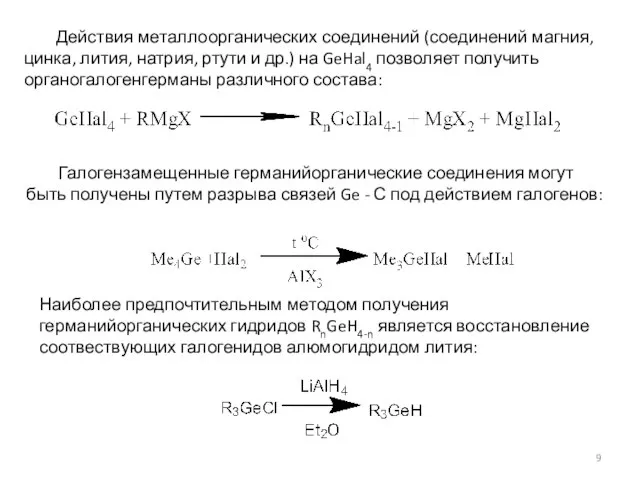
- 9. Действия металлоорганических соединений (соединений магния, цинка, лития, натрия, ртути и др.) на GeHal4 позволяет получить органогалогенгерманы
- 10. Германий реагирует с кислотами: Ge + H2SO4 (конц) = Ge(SO4)2 + 2SO2↑ + 4H2O, Ge +
- 11. При нагревании на воздухе до 700 °C Ge загорается при температуре образуется диоксид германия GeO2. Ge
- 12. С щелочами GeO2 взаимодействует как кислотный оксид: GeO2 + 2NaOH = Na2GeO3 + H2O GeO2 взаимодействует
- 13. Моногерман получают восстановлением диоксида германия GeO2 борогидридом натрия NaBH4: GeO2 + NaBH4 = GeH4↑ + NaBO2
- 14. Дисульфид германия GeS2 — белое аморфное или кристаллическое вещество, получается осаждением H2S из кислых растворов GeCl4:
- 16. Скачать презентацию










 Ионные уравнения реакций
Ионные уравнения реакций Простое вещество и химический элемент азот
Простое вещество и химический элемент азот Задачи химической кинетики
Задачи химической кинетики Щелочноземельные металлы
Щелочноземельные металлы К 180-летию со дня рождения Д.И. Менделеева
К 180-летию со дня рождения Д.И. Менделеева Окислительно – восстановительные реакции (урок химии в 11 классе)
Окислительно – восстановительные реакции (урок химии в 11 классе) Угольная кислота
Угольная кислота Вазелин и вазелиновое масло
Вазелин и вазелиновое масло Учение о химических процессах. Лекция 3
Учение о химических процессах. Лекция 3 Углерод
Углерод Обмен жиров в организме млекопитающего
Обмен жиров в организме млекопитающего Азот. Нахождение в природе
Азот. Нахождение в природе Развитие ассоциативного мышления на уроках химии
Развитие ассоциативного мышления на уроках химии Общая характеристика нефти и газа
Общая характеристика нефти и газа Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение
Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение Типы химических реакций в органической химии
Типы химических реакций в органической химии Содержание варианта ЕГЭ
Содержание варианта ЕГЭ Коррозия металла
Коррозия металла Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Основы химического анализа. Лекция 7
Основы химического анализа. Лекция 7 Problem-solving. Test: real-time polymerase chain reaction
Problem-solving. Test: real-time polymerase chain reaction Альдегиды. Строение молекул
Альдегиды. Строение молекул Хладостойкие неметаллические материалы
Хладостойкие неметаллические материалы Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Химико-технологические процессы современных производств
Химико-технологические процессы современных производств Презентация по Химии "Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит»"
Презентация по Химии "Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит»" 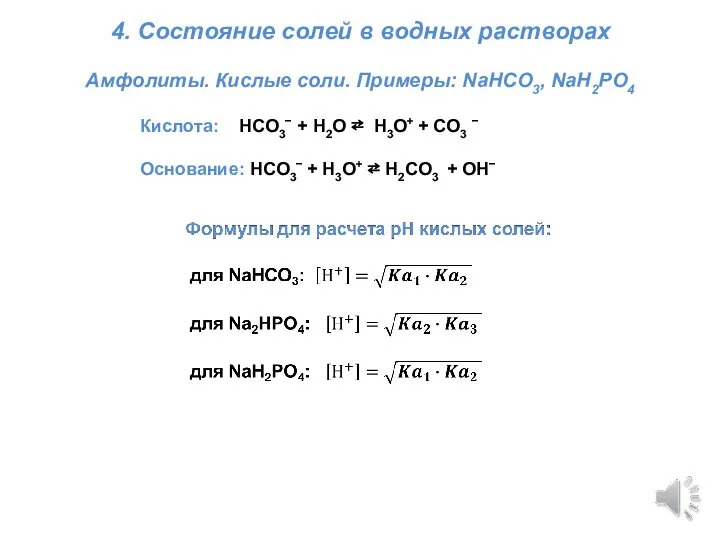 Титриметрия. Состояние солей в водных растворах
Титриметрия. Состояние солей в водных растворах