Содержание
- 2. История создания учения о строении атома Впервые вопрос из чего состоят все тела был зафиксирован в
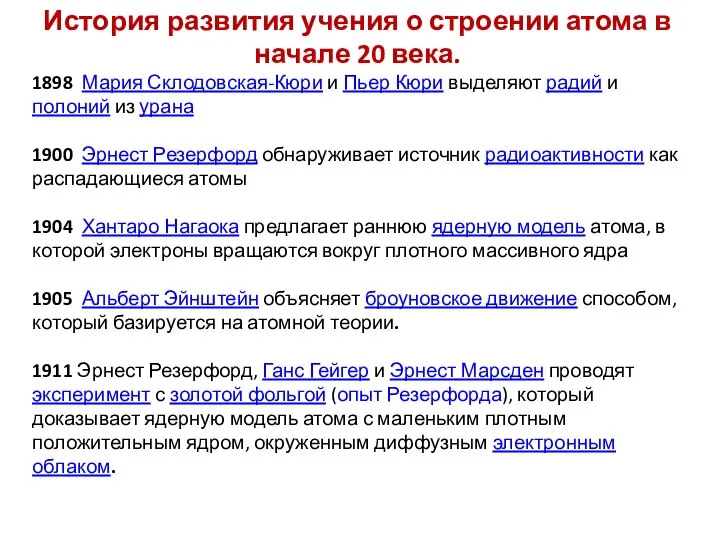
- 3. История развития учения о строении атома в начале 20 века. 1898 Мария Склодовская-Кюри и Пьер Кюри
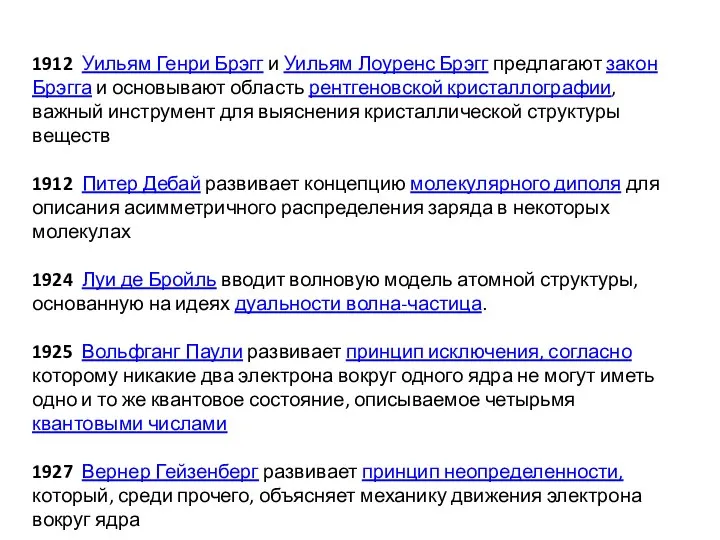
- 4. 1912 Уильям Генри Брэгг и Уильям Лоуренс Брэгг предлагают закон Брэгга и основывают область рентгеновской кристаллографии,
- 5. Косвенные свидетельства сложности строения атомов химических элементов Электролитическая диссоциация Электролиз Фотоэффект Естественная радиоактивность (Беккерель, 1896 г,
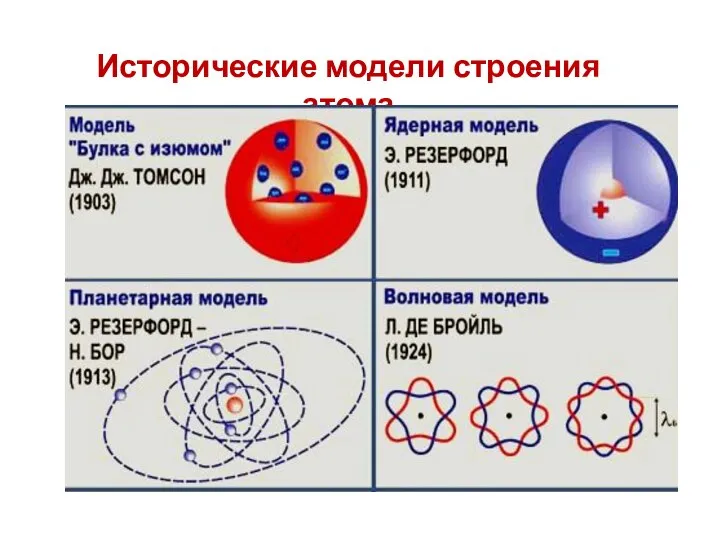
- 6. Исторические модели строения атома
- 7. Английский физик Эрнст Резерфорд открыл α- и β-излучение короткоживущих изотопов радона и множество других изотопов. Объяснил
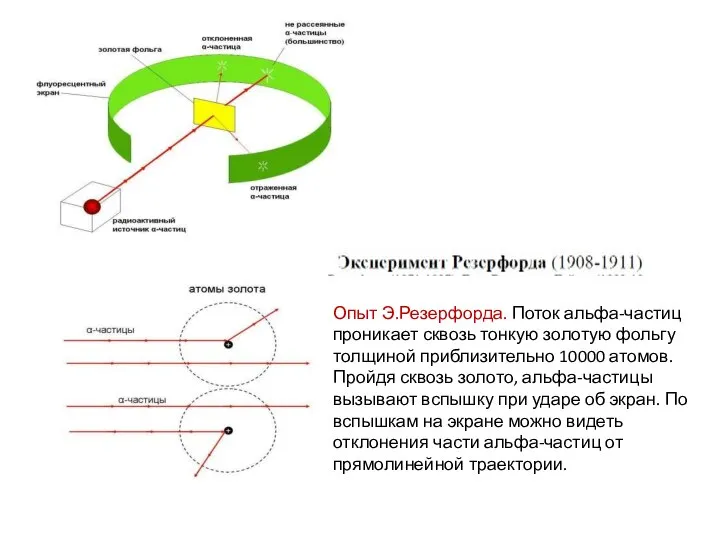
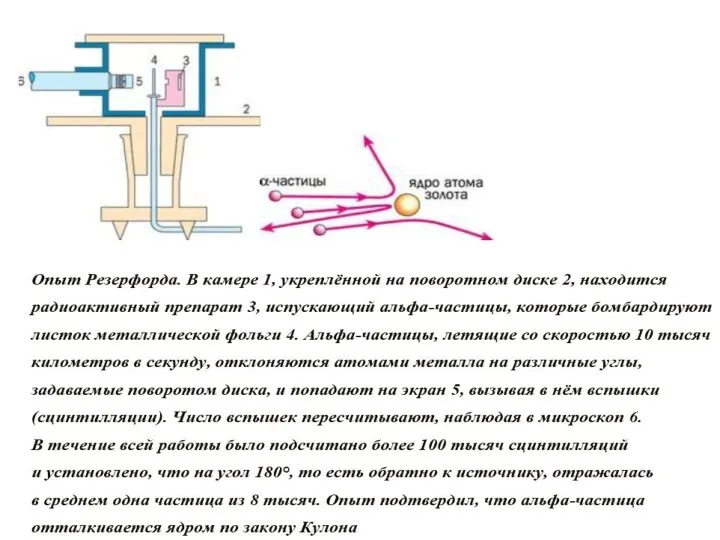
- 8. Опыт Э.Резерфорда. Поток альфа-частиц проникает сквозь тонкую золотую фольгу толщиной приблизительно 10000 атомов. Пройдя сквозь золото,
- 10. Э. Резерфорд показал, что почти вся масса атома сосредоточена в его ядре — небольшой (даже по
- 12. В 1913 г. Нильс Бор опубликовал серию статей «О строении атомов и молекул», открывших путь к
- 13. Нильс Бор (1885-1962) Теория Бора позволила объяснить экспериментальные факты (спектры атома водорода), чего не могла сделать
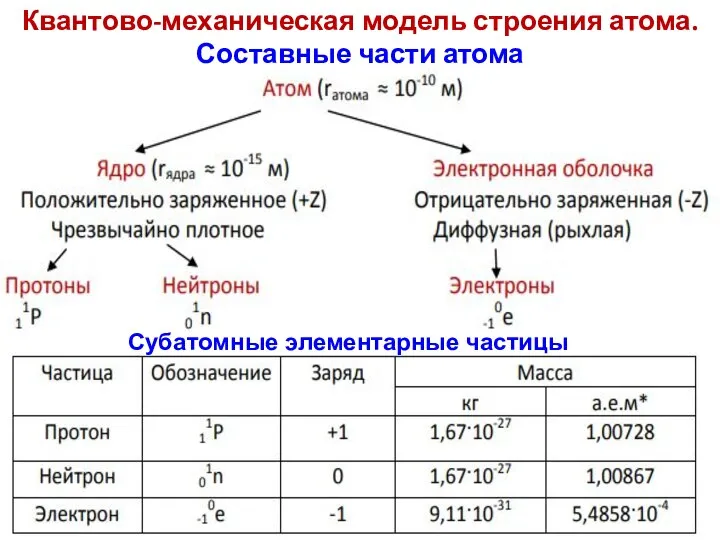
- 14. Квантово-механическая модель строения атома. Составные части атома Субатомные элементарные частицы
- 15. Сравнение элементарных частиц: -протоны и нейтроны почти в 1836 раз тяжелее электронов. Следовательно, масса любого тела
- 16. mатома = mядра + mэлектронов ≈ mядра mатома ≈ mядра ≈ Z·mp + N·mn ≈ (Z
- 17. Химический элемент является смесью изотопов с постоянным относительным содержанием изотопов. Определяемая экспериментально средняя атомная масса элемента
- 18. Двойственная природа электромагнитного излучения λДе Бройля - длина материальной волны де Бройля; mчастицы — масса частицы,
- 19. Двойственная корпускулярно-волновая природа микрочастиц (электрона). Постулат де Бройля Французский ученый Луи де Бройль (1892—1987), развивая представления
- 20. Волна де Бройля для электрона сравнима с размерами атомов и соответствует диапазону рентгеновского излучения. Волновые свойства
- 21. Принцип неопределенности Гейзенберга 1. Невозможно с высокой степенью точности установить координаты местоположения и величину скорости движения
- 22. Уравнение Шредингера В 1926 году австрийский физик Э. Шредингер предложил уравнение, описывающее движение микрочастиц, проявляющих волновые
- 23. Уравнение Шредингера
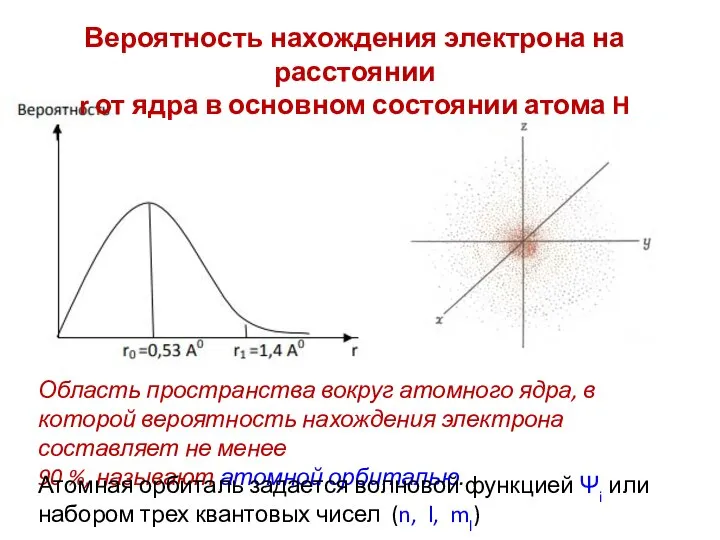
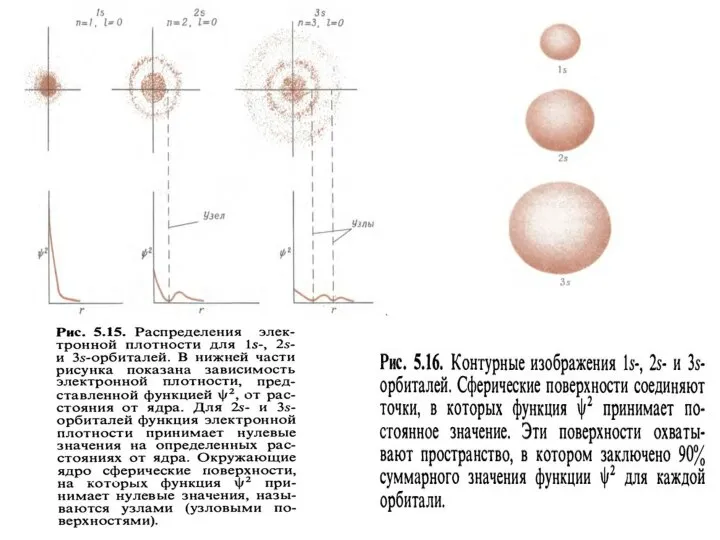
- 24. Вероятность нахождения электрона на расстоянии r от ядра в основном состоянии атома H Область пространства вокруг
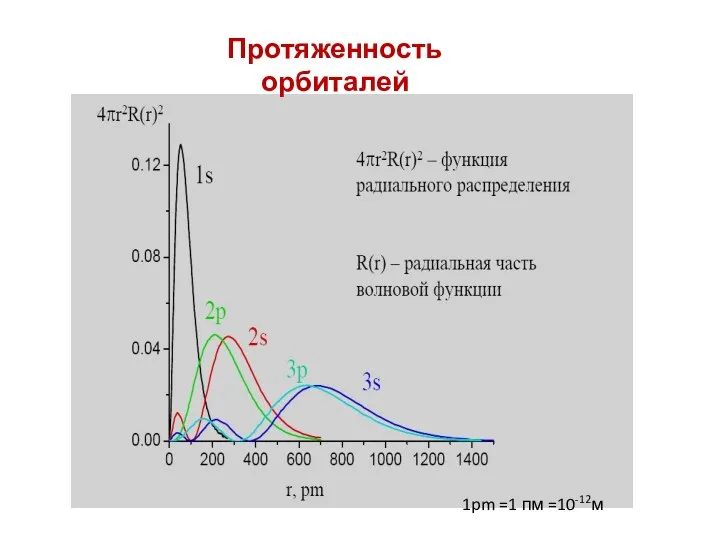
- 25. Протяженность орбиталей 1pm =1 пм =10-12м
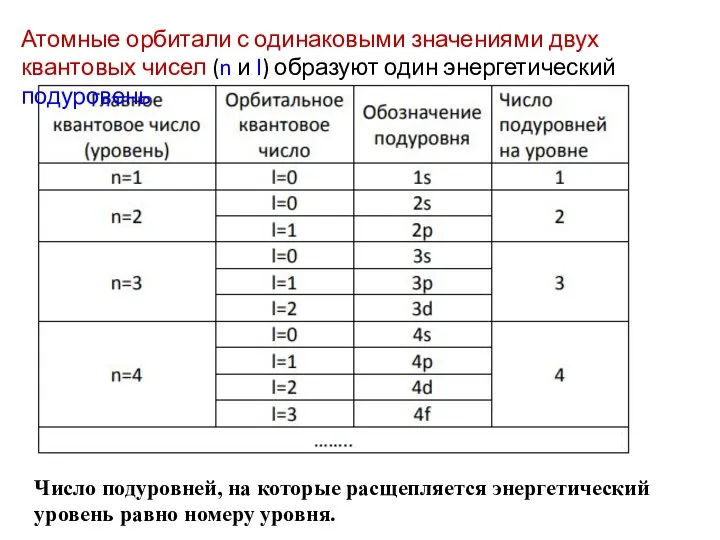
- 27. Квантовые числа, характеризующие состояния электронов в атоме Главное квантовое число (n) – характеризует энергию электрона в
- 28. Главное квантовое число n Принимает положительные целочисленные значения от 1 до ∞ Характеризует энергию электрона в
- 29. Энергетическая диаграмма возможных состояний электрона в атоме водорода En = - 2,18·10-18 /n2 [дж/ат]
- 30. Еизл = Екон – Енач = Е2 – Е1 hν = 2,18·10-18(-1/n2кон +1/n2нач) Электронные переходы между
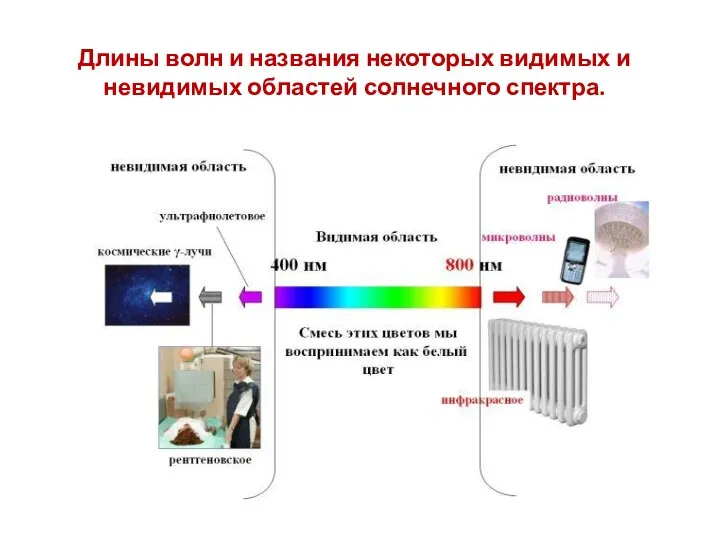
- 31. Длины волн и названия некоторых видимых и невидимых областей солнечного спектра.
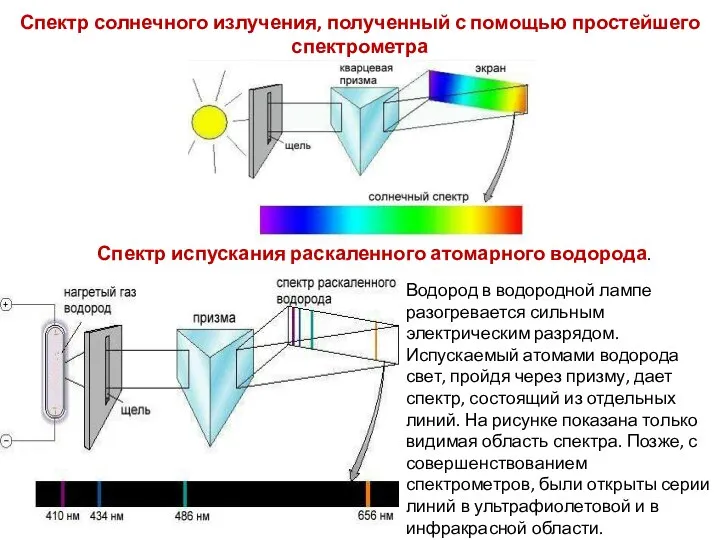
- 32. Спектр солнечного излучения, полученный с помощью простейшего спектрометра Водород в водородной лампе разогревается сильным электрическим разрядом.
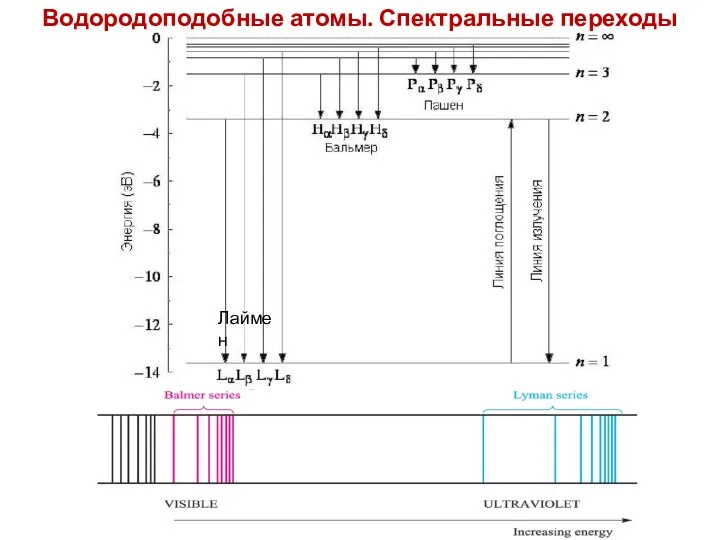
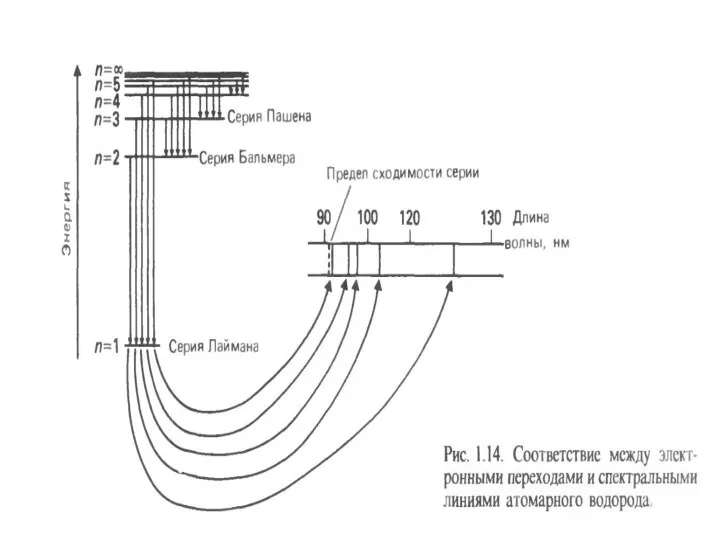
- 33. Водородоподобные атомы. Спектральные переходы Лаймен
- 34. Атомный спектр испускания водорода
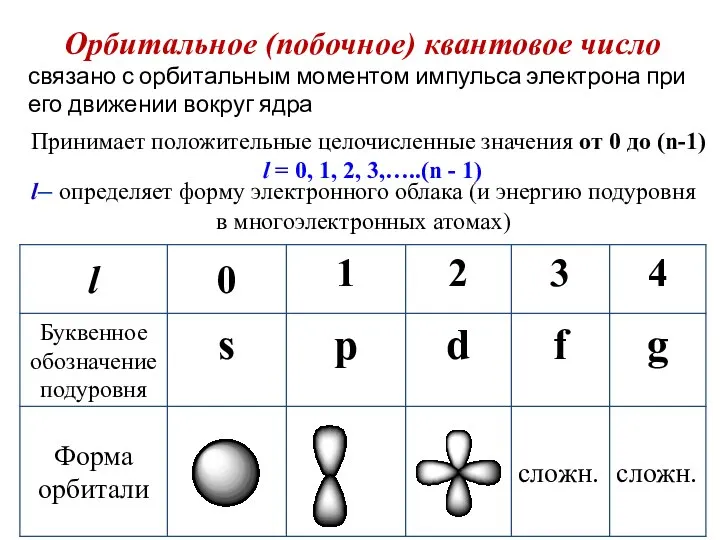
- 36. Орбитальное (побочное) квантовое число Принимает положительные целочисленные значения от 0 до (n-1) l = 0, 1,
- 37. Атомные подуровни Энергетический подуровень – это совокупность электронных состояний, характеризующихся определенным набором двух квантовых чисел n
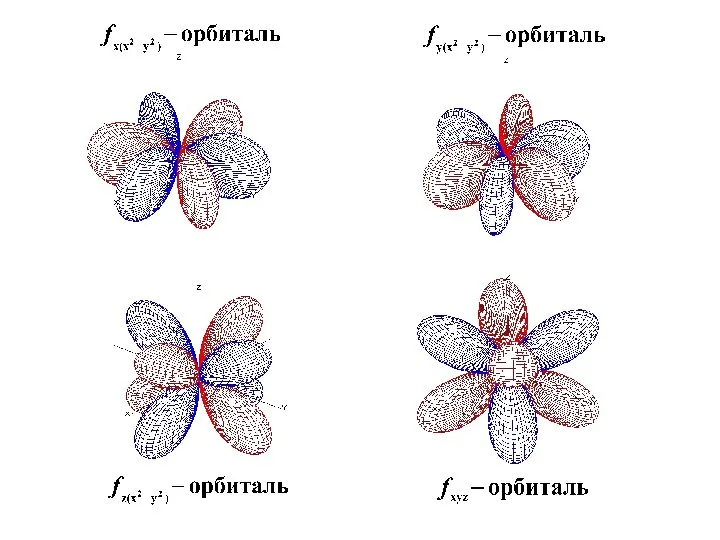
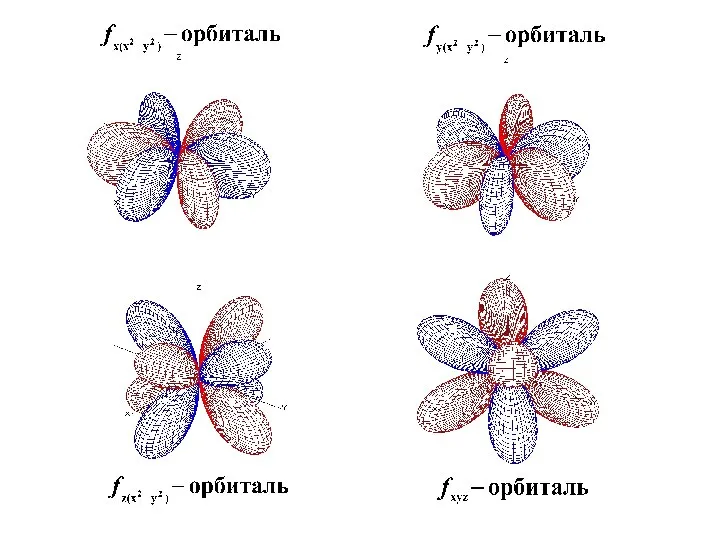
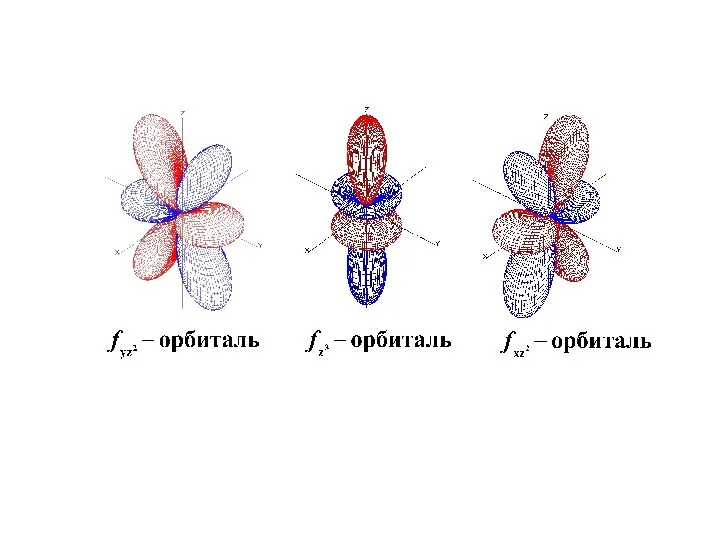
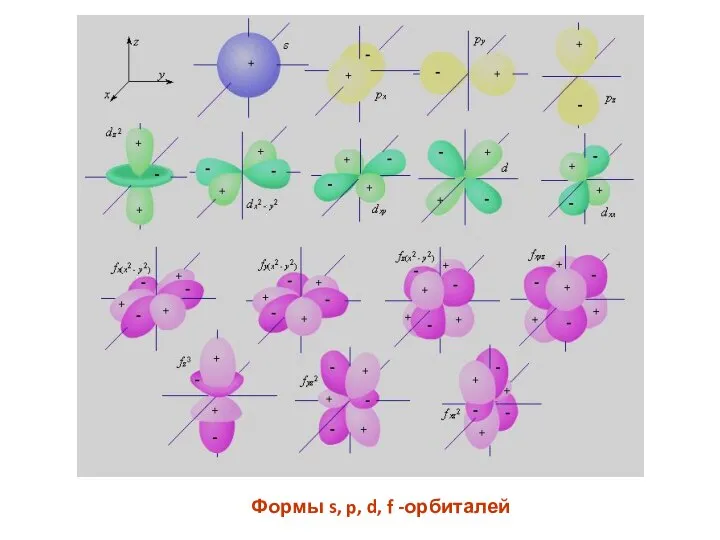
- 43. Формы s, p, d, f -орбиталей
- 44. Число подуровней, на которые расщепляется энергетический уровень равно номеру уровня. Атомные орбитали с одинаковыми значениями двух
- 45. Магнитное квантовое число ml Магнитное квантовое число ml принимает отрицательные и положительные целочисленные значения от –
- 46. Следовательно, число значений ml это число орбиталей с данным значением l ns - состоянию соответствует одна
- 47. Энергетическая диаграмма возможных состояний электрона в атоме водорода En = - 2,18·10-18 /n2 [дж/ат]
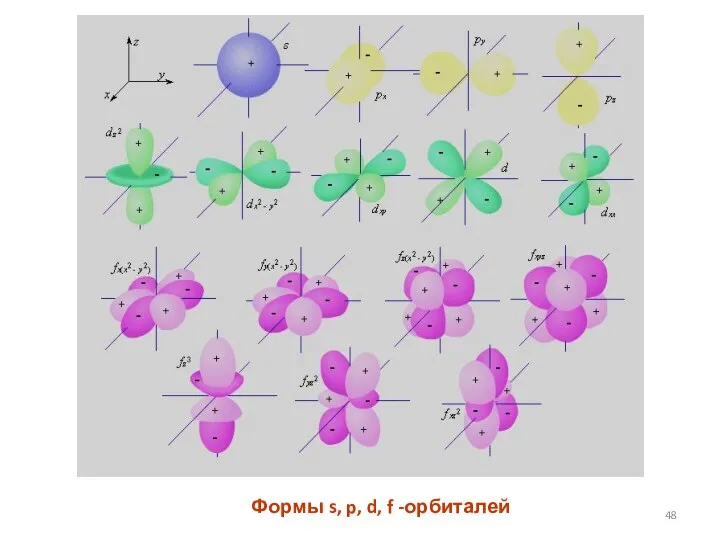
- 48. Формы s, p, d, f -орбиталей
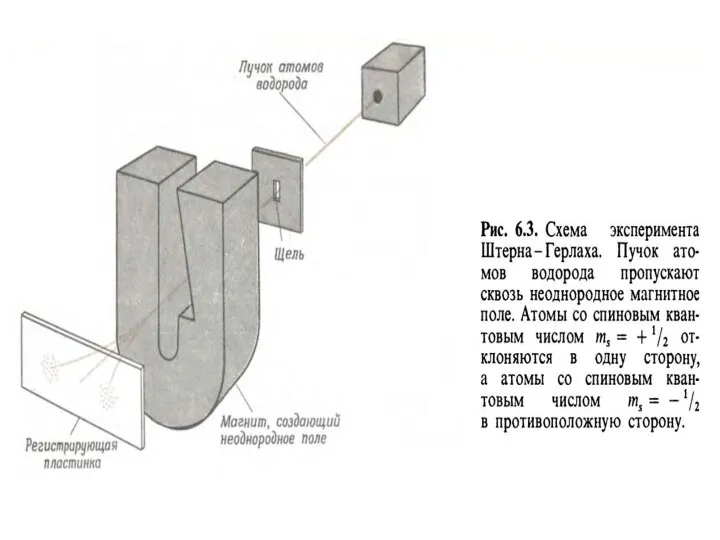
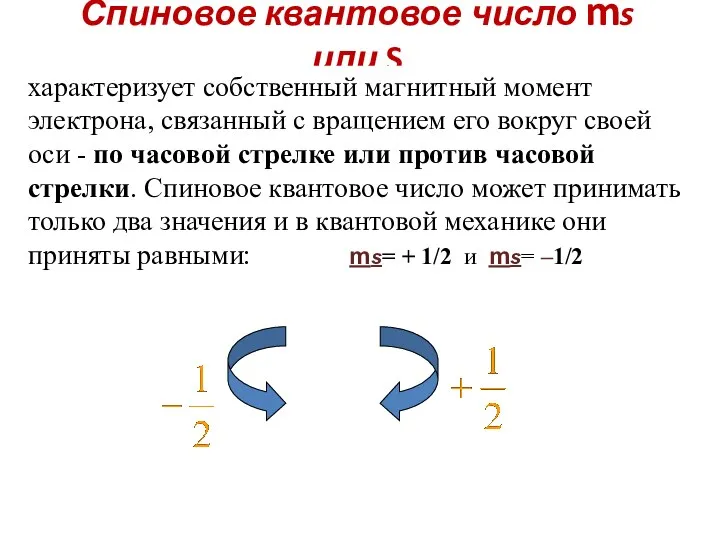
- 50. Спиновое квантовое число ms или S характеризует собственный магнитный момент электрона, связанный с вращением его вокруг
- 51. Состояние электронов в многоэлектронных атомах Особенности: 1. Заряд ядра увеличивается, электронные оболочки сильнее притягиваются к ядру,
- 52. С ростом заряда ядра электроны сильнее притягиваются к ядру, и энергии атомных орбиталей понижаются. Энергия 1s-орбитали
- 53. Энергия электронов в многоэлектронных атомах
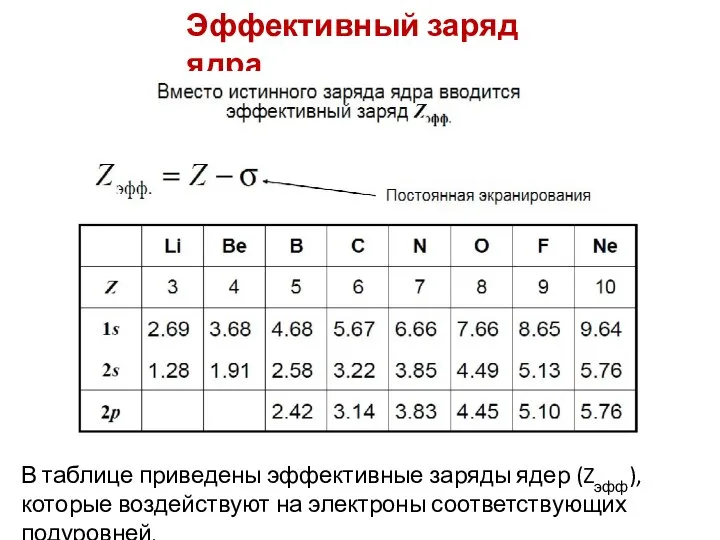
- 54. Эффективный заряд ядра В таблице приведены эффективные заряды ядер (Zэфф), которые воздействуют на электроны соответствующих подуровней.
- 55. Правила расчета постоянной экранирования (σ)
- 56. Расчет эффективного заряда Пример 1: для валентного 2p электрона в атоме N Электронная конфигурация атома: N
- 57. Правила заполнения атомных орбиталей электронами Правила Клечковского (применимы только для определения последовательности заполнения атомных орбиталей) 1.
- 58. Заполнение электронами энергетических уровней и подуровней идет в следующем порядке: Например:…3s 3p 3d 4s 4p… (3+0)
- 59. Последовательность заполнения электронами уровней и подуровней 1s 2s2p 3s3p 4s3d4p 5s4d5p (n+l) 1 2 3 3
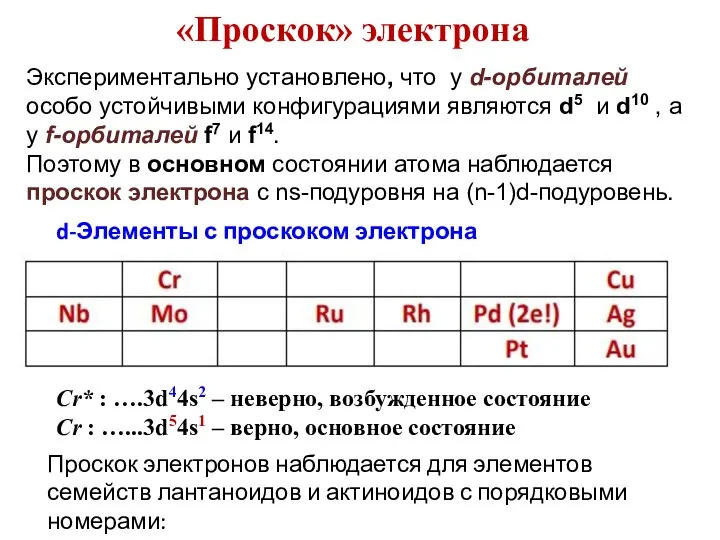
- 60. «Проскок» электрона Экспериментально установлено, что у d-орбиталей особо устойчивыми конфигурациями являются d5 и d10 , а
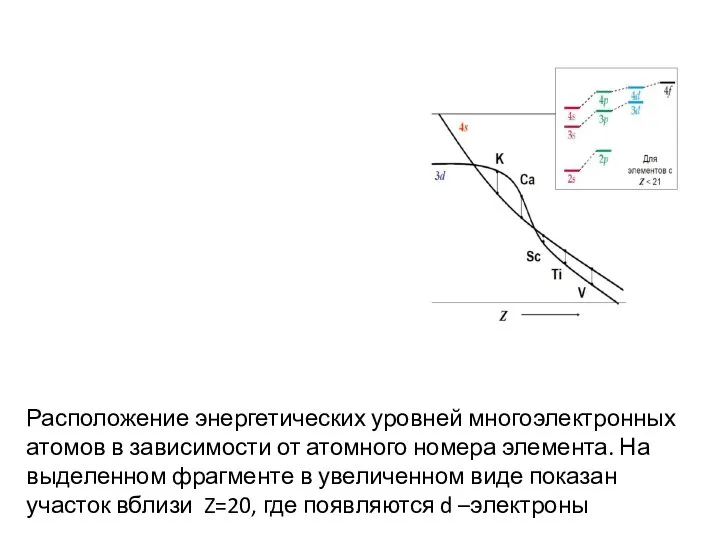
- 61. Расположение энергетических уровней многоэлектронных атомов в зависимости от атомного номера элемента. На выделенном фрагменте в увеличенном
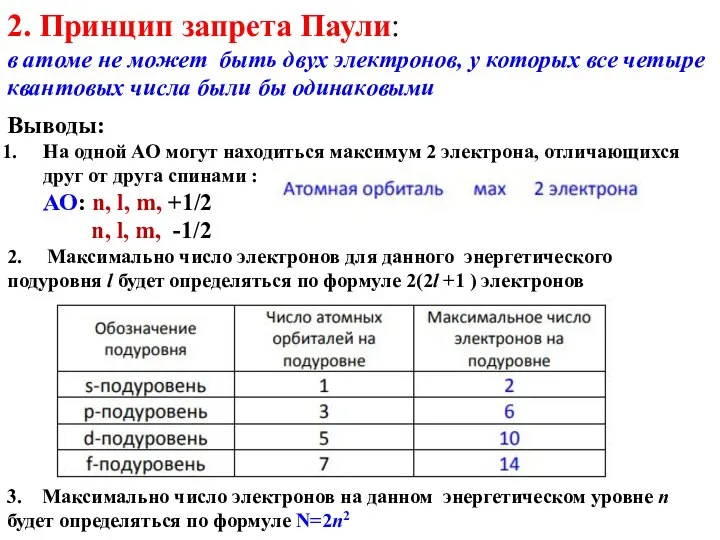
- 62. 2. Принцип запрета Паули: в атоме не может быть двух электронов, у которых все четыре квантовых
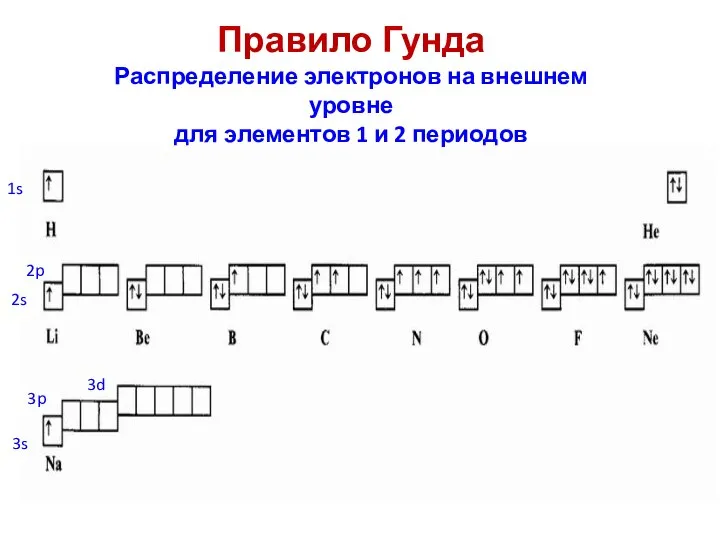
- 63. 3. Правило Гунда: энергетически вырожденные атомные орбитали одного подуровня заполняются последовательно по одному электрону с параллельными
- 64. Правило Гунда Распределение электронов на внешнем уровне для элементов 1 и 2 периодов 2s 2p 3s
- 65. 1. Полная электронная формула: 34Se 1s22s22p63s23p64s23d104p4 2. Краткая электронная формула составляется, учитывая, что конфигурация внутренних электронов
- 66. Валентные электроны — электроны внешнего уровня и того предвнешнего подуровня, который заполняется у данного атома. Валентные
- 67. Типы элементов s-элементы: Элементы 1 и 2 групп (главные подгруппы I-II групп), имеющие в качестве валентных
- 68. Электронные конфигурации ионов Положительно заряженные ионы (катионы) образуются при отрыве электронов от атома А – ne
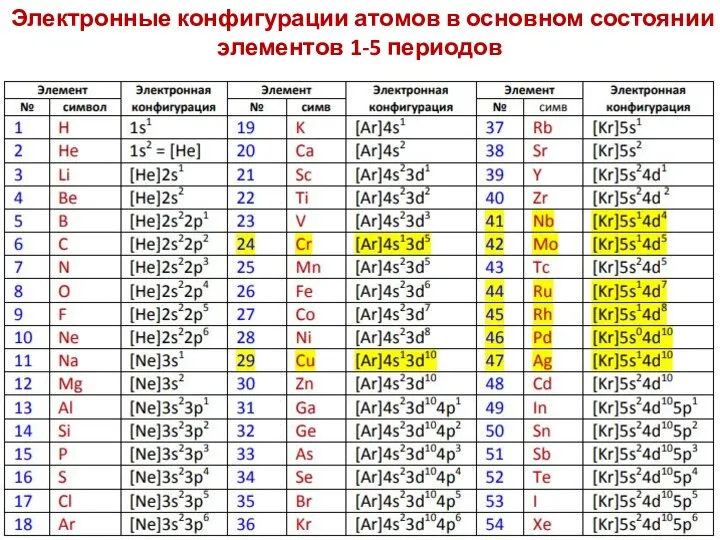
- 69. Электронные конфигурации атомов в основном состоянии элементов 1-5 периодов
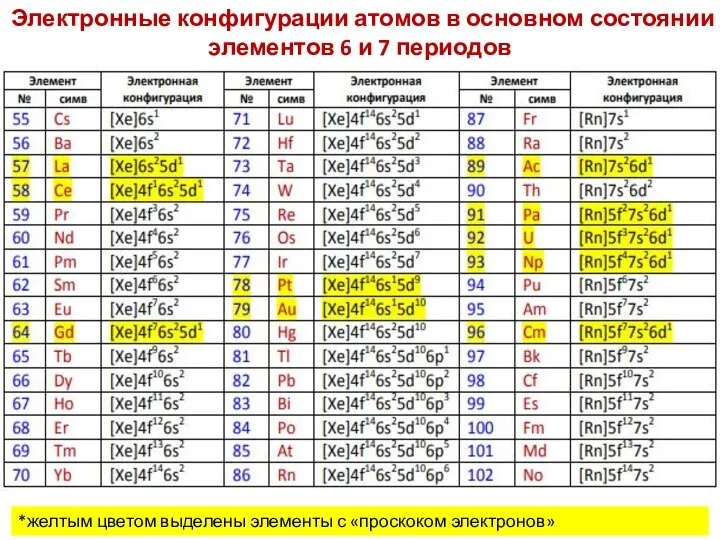
- 70. Электронные конфигурации атомов в основном состоянии элементов 6 и 7 периодов *желтым цветом выделены элементы с
- 72. Скачать презентацию


















![Энергетическая диаграмма возможных состояний электрона в атоме водорода En = - 2,18·10-18 /n2 [дж/ат]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/984368/slide-28.jpg)







![Энергетическая диаграмма возможных состояний электрона в атоме водорода En = - 2,18·10-18 /n2 [дж/ат]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/984368/slide-46.jpg)













 Классы неорганических веществ
Классы неорганических веществ Уксусная кислота
Уксусная кислота Природные источники углеводов
Природные источники углеводов Карбонаты. Кальцит. Малахит
Карбонаты. Кальцит. Малахит Нахождение формулы вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов Физические свойства алкенов
Физические свойства алкенов Изомерия
Изомерия Закон сохранения массы и химические уравнения
Закон сохранения массы и химические уравнения 01. Предмет органической химии. ТХСОС А. М. Бутлерова
01. Предмет органической химии. ТХСОС А. М. Бутлерова 06_Типы_химических_реакций_в_органической_химии
06_Типы_химических_реакций_в_органической_химии История органической химии. Урок химии в 10 классе
История органической химии. Урок химии в 10 классе Неметаллы. 8 класс
Неметаллы. 8 класс Азотная кислота
Азотная кислота Алгоритм решения задач по химии.
Алгоритм решения задач по химии. Композитные материалы
Композитные материалы Основные формулы МКТ
Основные формулы МКТ Циклоалканы. Номенклатура и строение
Циклоалканы. Номенклатура и строение Курсовая работа. Синтез адипиновой кислоты
Курсовая работа. Синтез адипиновой кислоты Количество вещества. Молярная масса. Молярный объем
Количество вещества. Молярная масса. Молярный объем Органическая химия- химия соединений углерода
Органическая химия- химия соединений углерода Теория-кинетика
Теория-кинетика Углерод и наше здоровье
Углерод и наше здоровье Классификация химических реакций
Классификация химических реакций Concise asymmetric total synthesis of lycopodine
Concise asymmetric total synthesis of lycopodine Удивительная соль
Удивительная соль Хладостойкие неметаллические материалы
Хладостойкие неметаллические материалы Простые вещества - металлы
Простые вещества - металлы Строение атома. История открытия атома
Строение атома. История открытия атома