Содержание
- 2. ВОДОРОД
- 3. Тест: общие сведения о водороде Необходимо выбрать правильные утверждения. Если вы согласны с утверждением, ставьте напротив
- 4. Определите, в каком из предложений речь идёт о химическом элементе, а в каком о простом веществе?
- 5. При помощи каких реакций можно получить водород, к какому типу относятся эти реакции? 2) Какими методами
- 6. Водород – самый распространенный химический элемент во Вселенной, является составной частью Солнца и звезд. В земной
- 7. Получение водорода Водород можно получить из природного газа, разложением воды, взаимодействием металлов с кислотами, взаимодействием активных
- 8. ТЕМА УРОКА «ХИМИЧЕСКИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА ВОДОРОДА И ЕГО ПРИМЕНЕНИЕ» Задачи:
- 9. Объясните, почему мыльные пузыри, заполненные водородом, поднимаются в вверх.
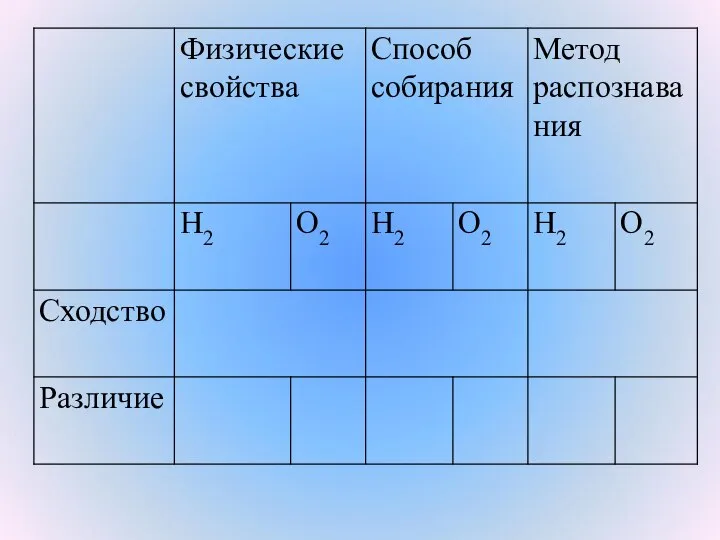
- 10. Физические свойства водорода Водород – бесцветный, самый легкий газ, в 14,5 раз легче воздуха. Нерастворим в
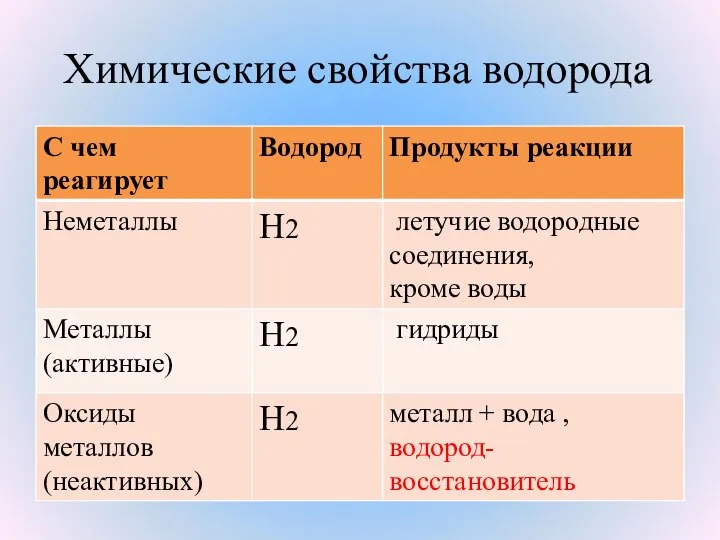
- 12. Химические свойства
- 13. Горение водорода 2H2 + O2= 2H2O 2 объема Н2 и 1 объем О2 – «гремучий газ»
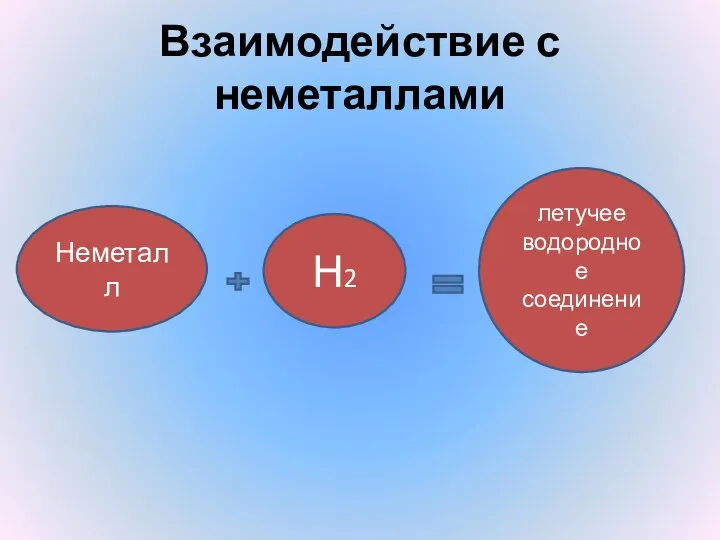
- 14. Взаимодействие с неметаллами Неметалл Н2 летучее водородное соединение
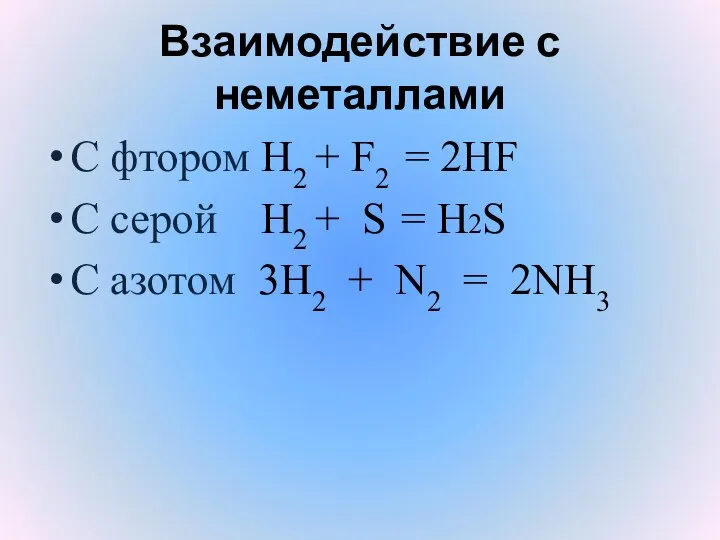
- 15. Взаимодействие с неметаллами С фтором H2 + F2 = 2HF С серой H2 + S =
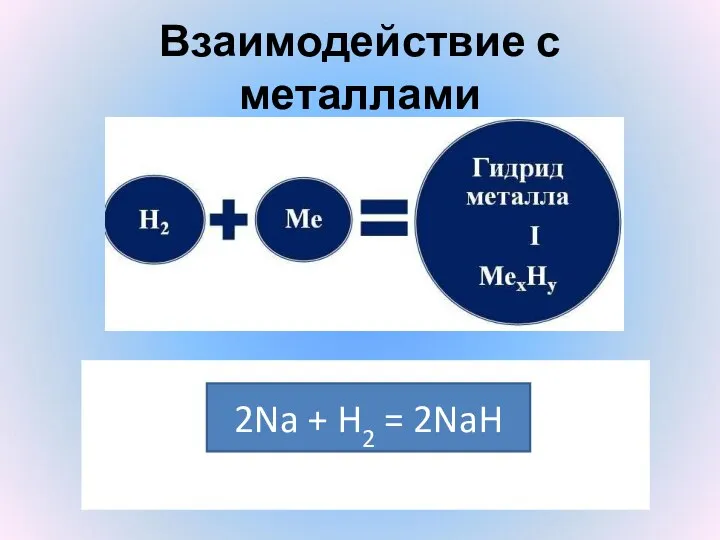
- 16. Взаимодействие с металлами 2Na + H2 = 2NaH
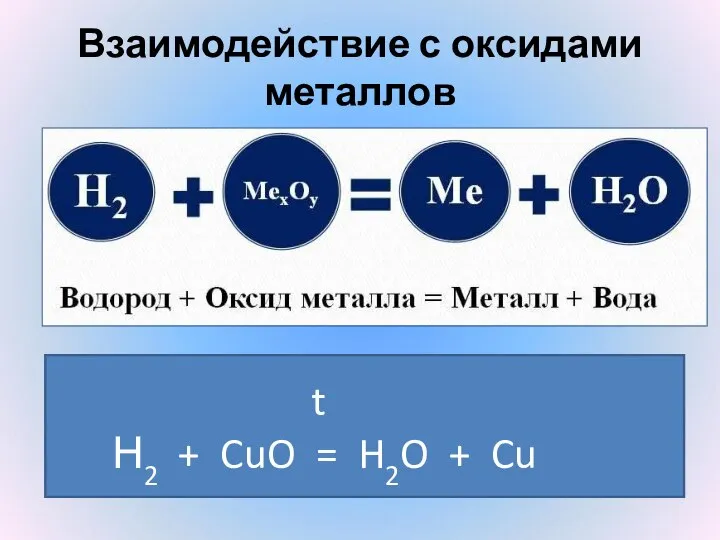
- 17. Взаимодействие с оксидами металлов Н2 + CuO t =Н2 + CuO t = H2O + Cu
- 18. Химические свойства водорода
- 19. Предложите способы использования водорода на основании изученных свойств
- 20. Использование водорода в качестве топлива автомобилей. При сгорании водорода в кислороде образуется экологически чистый продукт –
- 21. Использование водорода в ракетных двигателях. Жидкий водород является распространенным компонентом ракетного топлива
- 22. Использование водорода в металлургической промышленности Водород как восстановитель, для получения металлов и неметаллов (кремния, вольфрама)
- 23. Сварка металла Смесь кислорода с водородом используют при сварке и резке металлов.
- 24. Синтез водородсодержащих веществ Синтез аммиака NH3 Синтез хлороводорода и соляной кислоты HCl
- 25. Производство стекла Водород является активным газом, в соединениях с азотом может использоваться в производстве листового, полого
- 26. В пищевой промышленности Превращение растительных масел в твердые жиры – маргарин
- 27. Выберите признаки, характерные для водорода 1) Газ, поддерживающий горение 2) Легче воздуха 3) В лаборатории получают
- 28. Составьте уравнения реакций взаимодействия водорода со следующими веществами: I Cl2 + H2 = HCl II Ca
- 29. Проверка выполнения задания Cl2 + H2 = 2HCl Ca + H2 = Ca H2 HgO +
- 31. Скачать презентацию






















 Согласованное и несогласованное действие заместителей в бензольном кольце
Согласованное и несогласованное действие заместителей в бензольном кольце Ароматические углеводороды. Бензол
Ароматические углеводороды. Бензол Химия и автомобиль
Химия и автомобиль Титан — металл фей
Титан — металл фей Химическая организация природы
Химическая организация природы Степень окисления. Классификация неорганических соединений
Степень окисления. Классификация неорганических соединений Классификация веществ. Кислоты. Основания. Соли
Классификация веществ. Кислоты. Основания. Соли 1. Классификация материалов
1. Классификация материалов Основные диагностические признаки сапфира и его имитаций
Основные диагностические признаки сапфира и его имитаций Классификация НПВС (по химической структуре активности)
Классификация НПВС (по химической структуре активности) Химический состав клетки. Урок биологии в 10 классе
Химический состав клетки. Урок биологии в 10 классе Тренажер Химическая азбука для учащихся 8 класса
Тренажер Химическая азбука для учащихся 8 класса Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Клеящие материалы
Клеящие материалы Соли. Применение солей
Соли. Применение солей Химическое равновесие
Химическое равновесие Презентация на тему Железо и его соединения (9 класс)
Презентация на тему Железо и его соединения (9 класс)  Кроссворд Интересные факты в химии
Кроссворд Интересные факты в химии Атом. Ядро и электронная оболочка
Атом. Ядро и электронная оболочка Элемент Фосфор
Элемент Фосфор Соли азотной кислоты
Соли азотной кислоты Дифференциальный термический анализ
Дифференциальный термический анализ Современные инновации в области химической промышленности и пути её развития
Современные инновации в области химической промышленности и пути её развития Скорость химической реакции. Химическое равновесие
Скорость химической реакции. Химическое равновесие Генетич_связь_Проявление_периодического_закона
Генетич_связь_Проявление_периодического_закона Пероксид щелочных металлов
Пероксид щелочных металлов Презентация на тему Химическое равновесие
Презентация на тему Химическое равновесие  Распределение электронов в атомах
Распределение электронов в атомах