Содержание
- 2. Структура Периодической системы химических элементов. Д.И. Менделеева ПЕРИОД – ГОРИЗОНТАЛЬНЫЙ РЯД Энергетические уровни, электронные уровни, орбитали,
- 3. 1891 год Ирландский физик Стони вел понятие ЭЛЕКТРОН (по-гречески «янтарь») – частица, которая переносит электричество. Английский
- 4. 1897 год ДЖ. Томсон предложил модель атома – «Пудинг с изюмом» электрон +
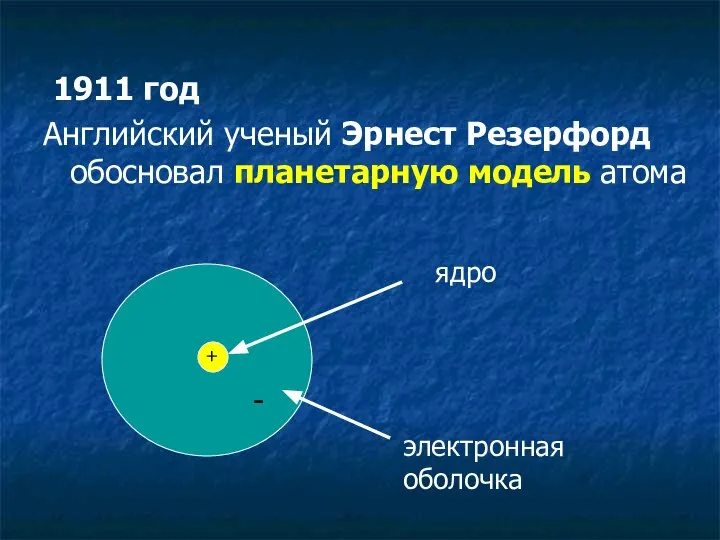
- 5. 1911 год Английский ученый Эрнест Резерфорд обосновал планетарную модель атома + ядро электронная оболочка -
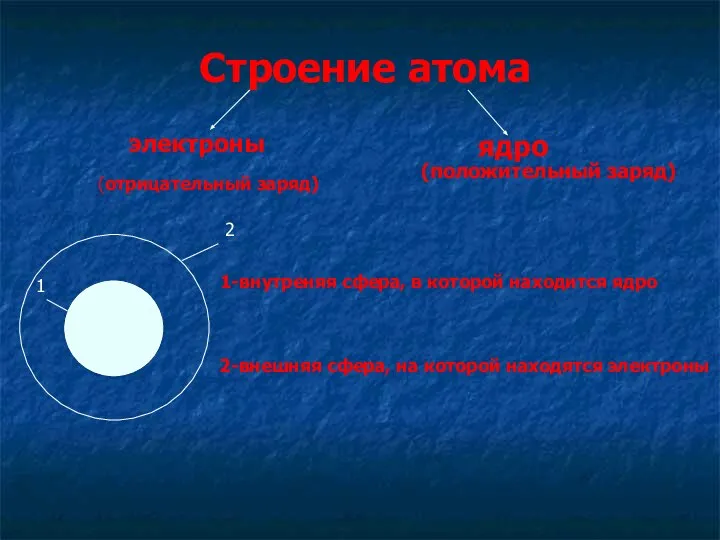
- 6. Строение атома электроны ядро 1-внутреняя сфера, в которой находится ядро 2-внешняя сфера, на которой находятся электроны
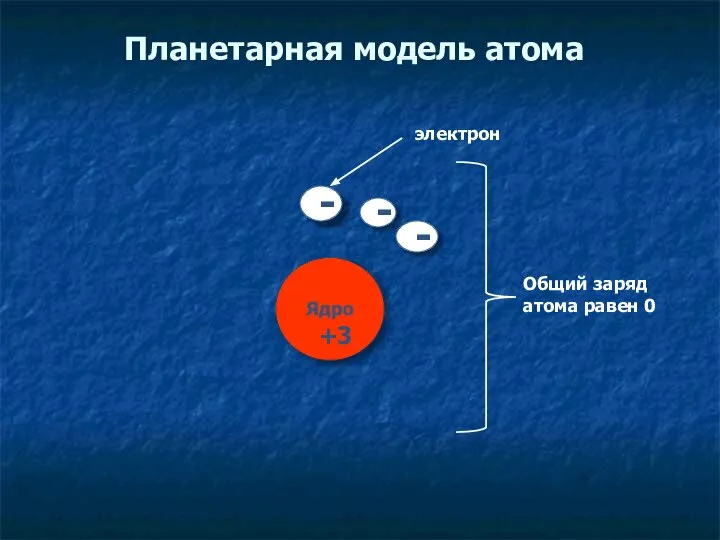
- 7. Планетарная модель атома электрон + Общий заряд атома равен 0 - 3 - -
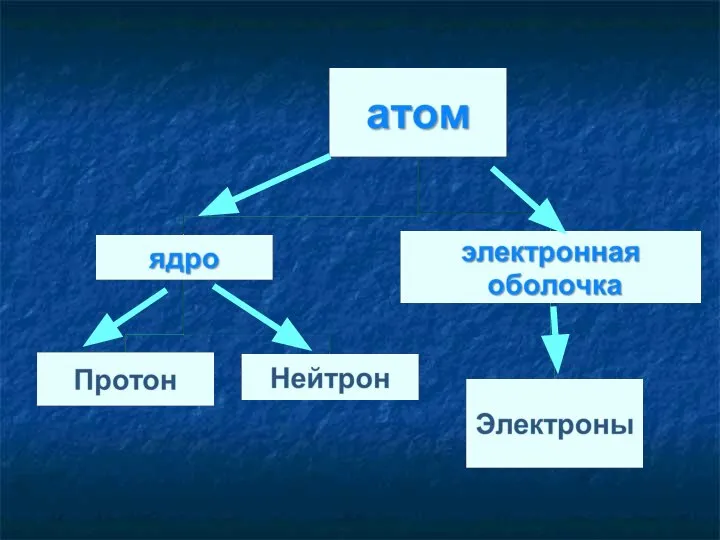
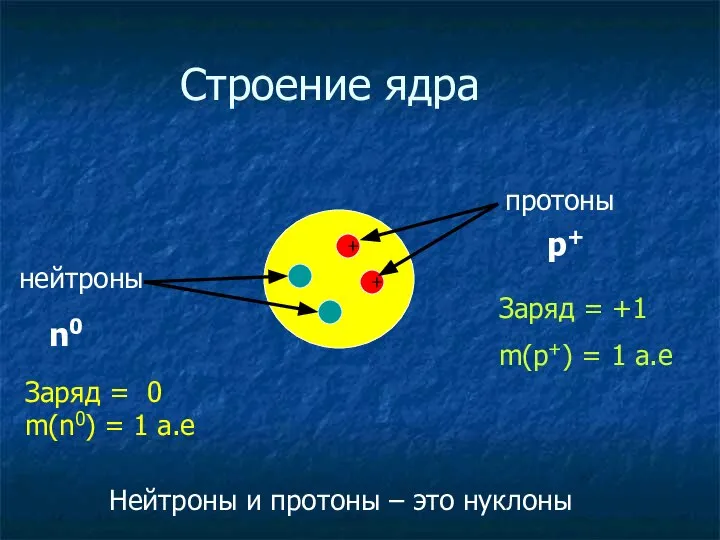
- 9. + + Строение ядра протоны нейтроны n0 p+ Заряд = +1 m(p+) = 1 a.e Заряд
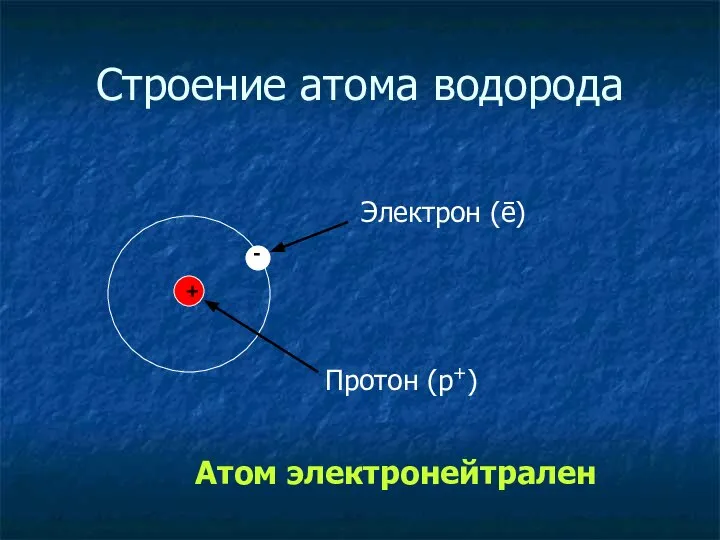
- 10. Строение атома водорода + - Протон (p+) Электрон (ē) Атом электронейтрален
- 11. Современная модель атома Атом – электронейтральная частица Ядро атома – положительно заряженное Электроны – отрицательно заряженные
- 12. Число протонов = заряду атомного ядра = числу электронов = = порядковому номеру элемента Mg 12
- 13. Состав ядра атома Протоны. Масса = 1, заряд = +1 Нейтроны. Масса = 1, заряд =
- 14. Масса атома – это масса его ядра. Число протонов + число нейтронов = массовое число (Аr)
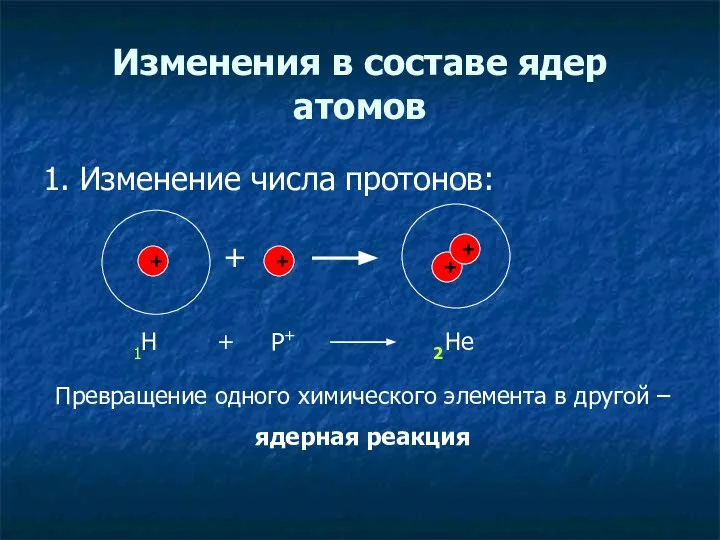
- 15. Изменения в составе ядер атомов 1. Изменение числа протонов: + + + + + 1Н Р+
- 16. Химический элемент – это вид атомов с одинаковым зарядом ядра (с одинаковым числом протонов в ядре)
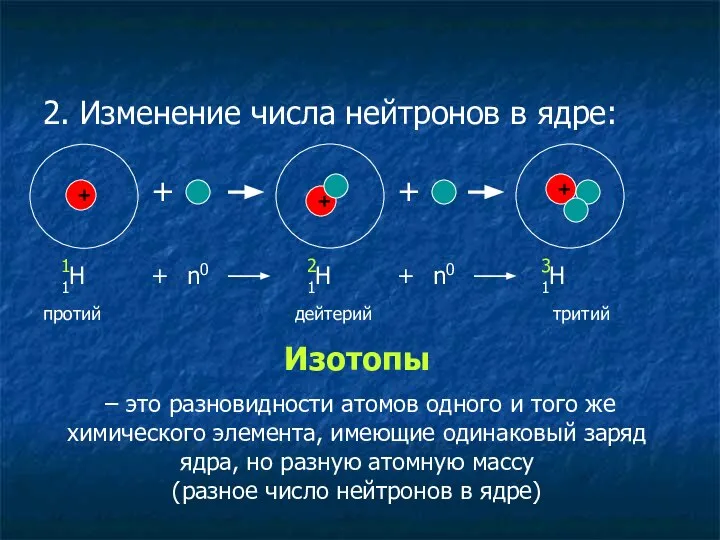
- 17. 2. Изменение числа нейтронов в ядре: + 1Н + + + + 1 + n0 1Н
- 18. 17 Сl 35 17 Сl 37 75% 25% Ar = 0.75 * 35 + 0.25 *
- 20. Скачать презентацию









 Целестин
Целестин Алюминий и алюминиевые сплавы
Алюминий и алюминиевые сплавы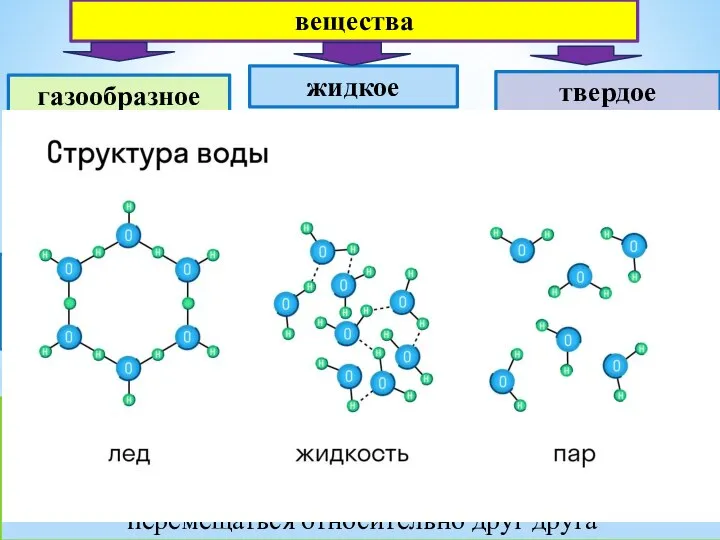 кристал решетка
кристал решетка А правда ли мыло волшебное?
А правда ли мыло волшебное? Презентация на тему Растворение. Растворы (8 класс)
Презентация на тему Растворение. Растворы (8 класс)  Роль органической химии в производстве и повседневной жизни человека
Роль органической химии в производстве и повседневной жизни человека Хим-1 презент
Хим-1 презент Алкадиены, каучуки
Алкадиены, каучуки Галогенпроизводные алканов. Методы получения
Галогенпроизводные алканов. Методы получения Клеящие материалы
Клеящие материалы Химические реакции. по фазовому составу
Химические реакции. по фазовому составу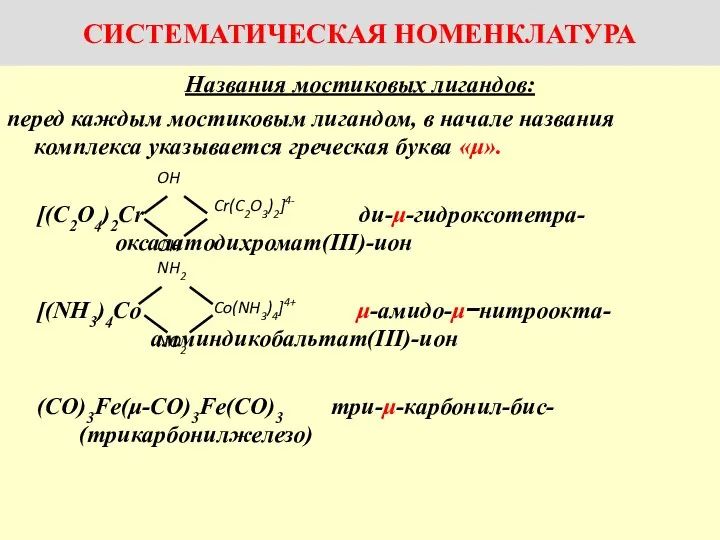 Названия комплексов с мостиковыми лигандами
Названия комплексов с мостиковыми лигандами Свойства веществ
Свойства веществ Презентация на тему Природные и синтетические красители и ароматизаторы
Презентация на тему Природные и синтетические красители и ароматизаторы  Строение вещества
Строение вещества Углеводы. Полисахариды. Важнейшие представители
Углеводы. Полисахариды. Важнейшие представители Таблица Менделеева
Таблица Менделеева Электролитическая диссоциация
Электролитическая диссоциация Nxf_uZGQ8YFvfhQYo-sHuA
Nxf_uZGQ8YFvfhQYo-sHuA Характеристика азота как химического элемента и простого вещества
Характеристика азота как химического элемента и простого вещества Каучук негізіндегі материалдар
Каучук негізіндегі материалдар Воздух
Воздух Почему амины считают органическими основаниями?
Почему амины считают органическими основаниями? Быстрорастущие кристаллы
Быстрорастущие кристаллы Презентация на тему Химия наука о веществах
Презентация на тему Химия наука о веществах  Классификация органических соединений
Классификация органических соединений Алкины. Строение
Алкины. Строение Сколько нужно чистого белка
Сколько нужно чистого белка