Слайд 2Химический словарь:
оксид, гидроксид, кислота, соль, химическая реакция, химическое уравнение, условия протекания

реакций, признаки течения химических реакций, алгоритм составления химической реакции, экзо- и эндотермическая реакция, закон сохранения массы веществ (автор), закон сохранения энергии (автор).
Слайд 3Укажите тип реакции
Преобразуйте схемы в уравнения реакций:
А) S + F2 →

SF6 ,
Б) Fe2O3 + H2 → Fe + H2O,
В) CO + O2 → CO2,
Г) Fe(OH)3 → Fe2O3 + ?,
Д) AgNO3 + KCl → AgCl + KNO3.
Слайд 4Закончите уравнения реакций:
А) соединения B +F2 → ? Sb + O2 →?
Б)

разложения H2O2 → H2O +?
В) замещения Al + H2SO4 → ?
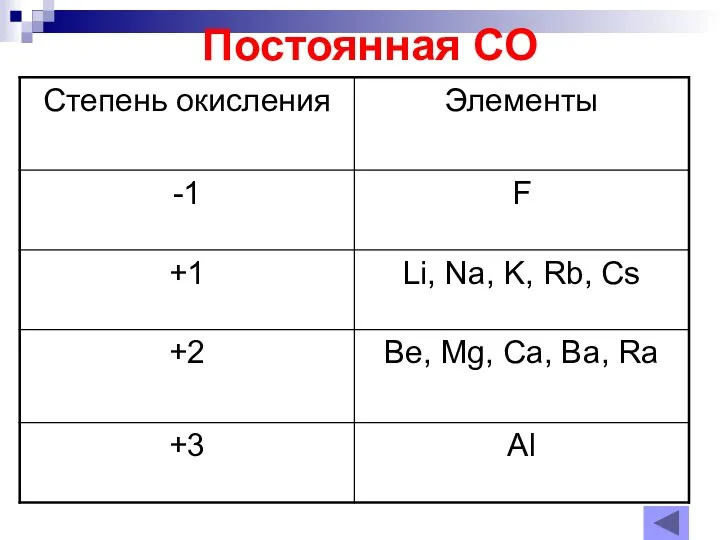
Слайд 6Степень окисления неметаллов – окислителей.

Слайд 7Химические реакции
с изменением степени окисления
2Н20 + О20 = 2Н2 +1О-2
без изменения

степени окисления
СаО + СО2 = СаСО3
Слайд 8Степень окисления – Условный заряд атомов химического элемента в соединении, вычисленный на

основе предположения, что все соединения только ионные.
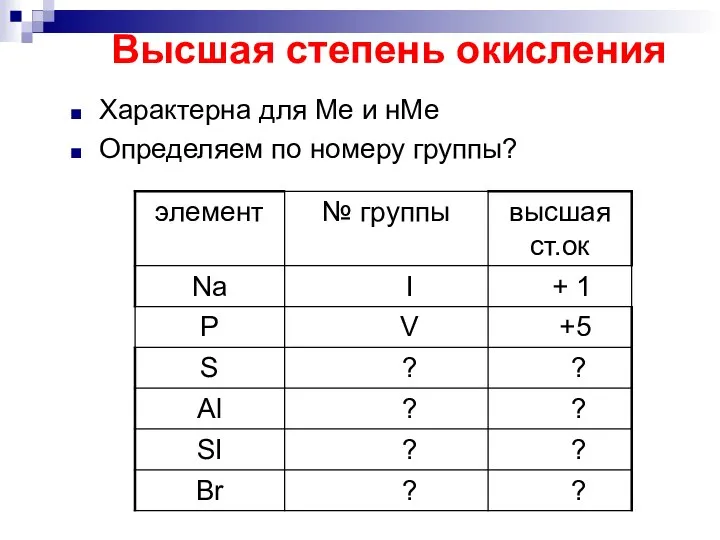
Слайд 9Высшая степень окисления
Характерна для Ме и нМе
Определяем по номеру группы?
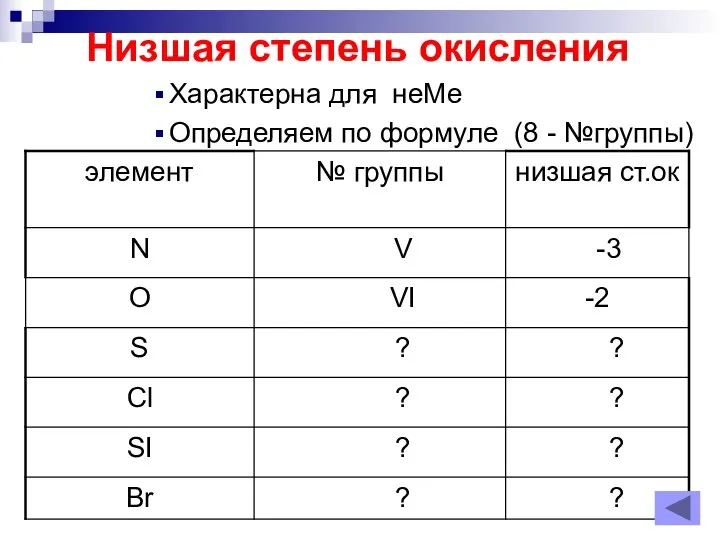
Слайд 10Низшая степень окисления
Характерна для неМе
Определяем по формуле (8 - №группы)
Слайд 12Алгоритм определения степеней окисления

Слайд 13 Вещества, содержащие атомы, которые понижают свою степень окисления и присоединяют электроны,

называются окислителями.
Вещества, содержащие атомы, которые повышают степень окисления и отдают электроны – восстановителями.
Еще есть такое шутливое правило: окислитель - грабитель, восстановитель - потерпевший.
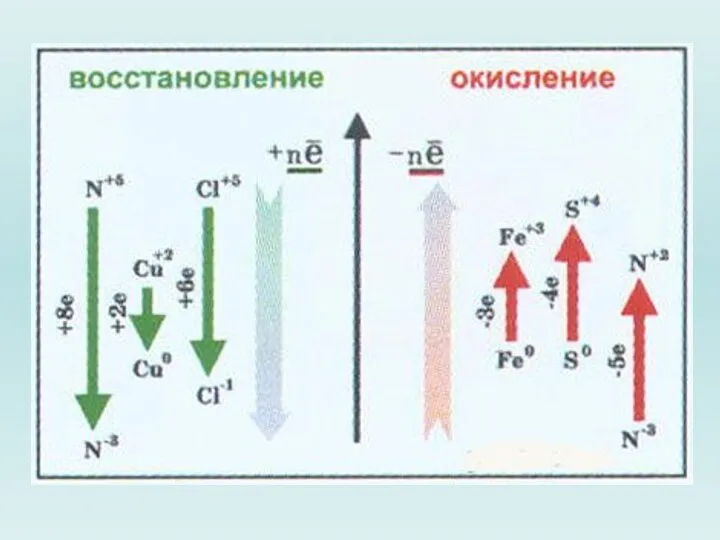
Слайд 15 Характерной особенностью окислительно-восстановительных реакций является изменение степени окисления, по меньшей мере

двух атомов: окисление одного (потеря электронов) и восстановление другого (присоединение электронов).
Окисление и восстановление - два полупроцесса, самостоятельное существование каждого из которых невозможно, но их одновременное протекание обеспечивает прохождение окислительно-восстановительного процесса.
Слайд 16 Алгоритм составления ОВР
Определить степени окисления элементов в соединениях, участвующих в реакции.
Выявить

элемент, степень окисления которого понизилась, повысилась, окислитель и восстановитель.
Выявить число отданных и принятых электронов.
Слайд 17Число отданных и принятых электронов должно быть одинаковым.
Если это не так,

то составить электронный баланс:
Найти НОК числа отданных и принятых электронов;
Делением НОК на число отданных и принятых получить коэффициенты перед окислителем и восстановителем;
Перенести коэффициенты в общее уравнение.
Слайд 20Значение окислительно - восстановительных процессов


















 Эфиры. 10 класс
Эфиры. 10 класс Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул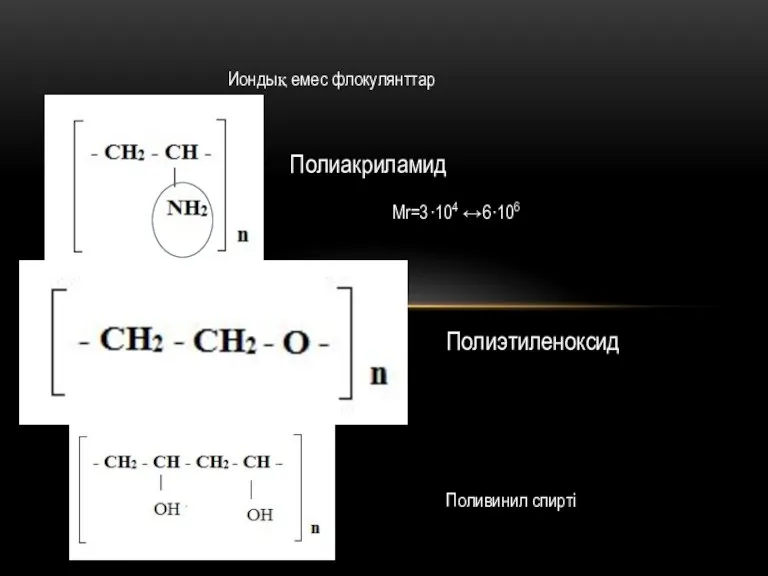 Иондық емес флокулянттар
Иондық емес флокулянттар Электронное строение
Электронное строение Олово и оловоорганические соединения, их свойства и применение
Олово и оловоорганические соединения, их свойства и применение Спирты
Спирты Коррозия металлов
Коррозия металлов Prezentatsia_lektsia_Reaktora_1_Klassifikatsia
Prezentatsia_lektsia_Reaktora_1_Klassifikatsia Органическая химия
Органическая химия Шухов Владимир Григорьевич (1853–1939)
Шухов Владимир Григорьевич (1853–1939) Алкины. Химические свойства
Алкины. Химические свойства Хімічний експеримент
Хімічний експеримент Физико-химические методы анализа. Лекция 4
Физико-химические методы анализа. Лекция 4 Германий, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение
Германий, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение Экстракция и кристаллизация
Экстракция и кристаллизация Наука Химия на Великой Отечественной войне
Наука Химия на Великой Отечественной войне Характеристика химического элемента-неметалла на основании его положения в ПСХЭ Д.И.Менделеева. 9 класс
Характеристика химического элемента-неметалла на основании его положения в ПСХЭ Д.И.Менделеева. 9 класс Применение личностно-ориентированного подхода в обучении химии
Применение личностно-ориентированного подхода в обучении химии Природные источники углеводородов
Природные источники углеводородов Комплексонометрическое титрование. Часть 2. Лекция 6
Комплексонометрическое титрование. Часть 2. Лекция 6 Презентация на тему Галогены и их соединения
Презентация на тему Галогены и их соединения 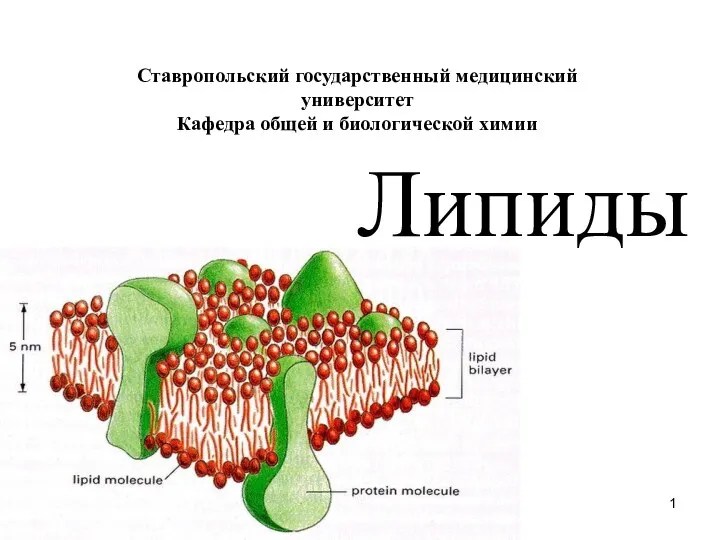 Липиды
Липиды Алканы
Алканы Химия в загадках
Химия в загадках Магний (Mg, Magnesium). Общая характеристика магния
Магний (Mg, Magnesium). Общая характеристика магния Особенности строения вещества. Лекция №2. Строение кристаллов
Особенности строения вещества. Лекция №2. Строение кристаллов Бериллий, магний и щелечноземельные металлы
Бериллий, магний и щелечноземельные металлы Материалы к уроку «Значение растворов» Автор: учитель СОШ № 4 Чурбакова Елена Васильевна
Материалы к уроку «Значение растворов» Автор: учитель СОШ № 4 Чурбакова Елена Васильевна