Содержание
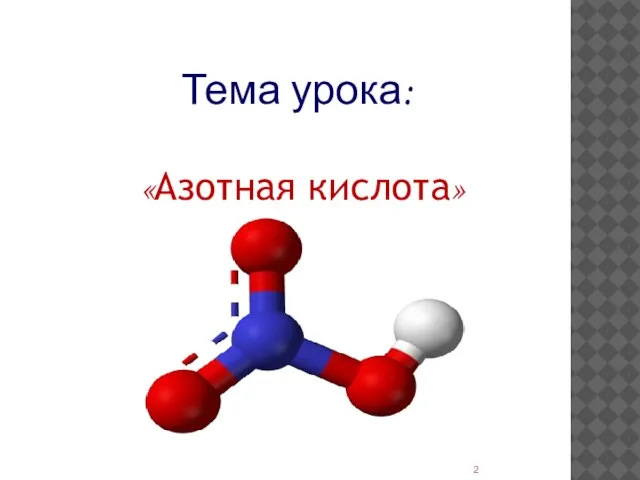
- 2. «Азотная кислота» Тема урока:
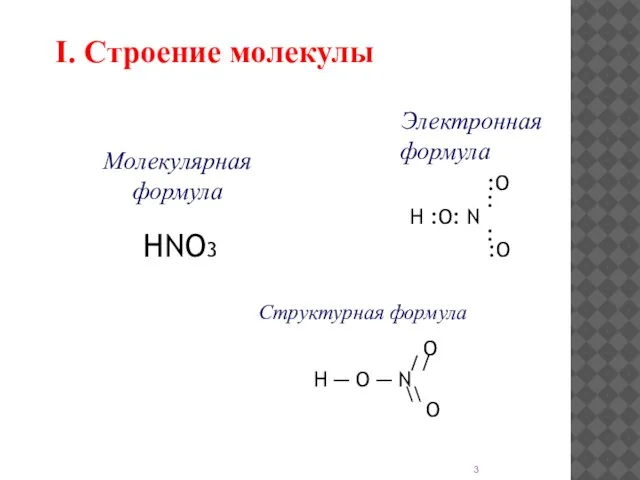
- 3. I. Строение молекулы Электронная формула :O : H :O: N : :O Структурная формула O //
- 4. По основности: одноосновная По содержанию «О»: кислородсодержащая По растворимости в воде: растворимая По стабильности: нестабильная По
- 5. Ж., з., ρ = 1,51 г/см3, tпл = - 420С, tкип = 860С НNO3 (конц., дымящая)
- 6. «Азотная кислота по характеру среди своих подруг - самая сильная и уверенная в себе . Внешне
- 7. I. Общие с другими кислотами НNO3 + лакмус фиолетовый = НNO3 + метиловый оранжевый = НNO3
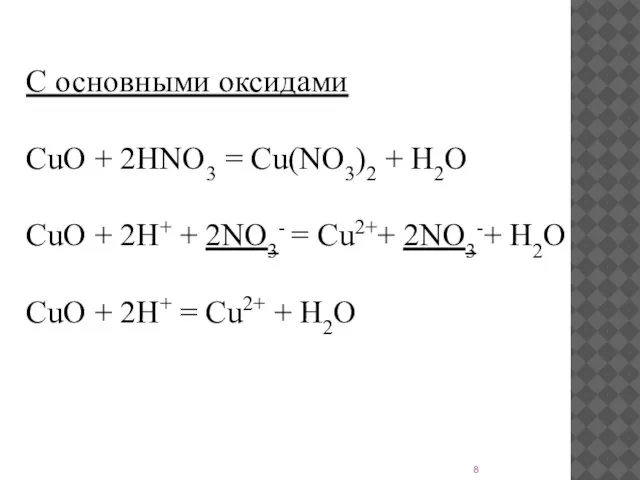
- 8. С основными оксидами CuO + 2HNO3 = Cu(NO3)2 + H2O CuO + 2H+ + 2NO3- =
- 9. С основаниями (нерастворимыми): Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O Cu(OH)2 + 2H++ 2NO 3- =
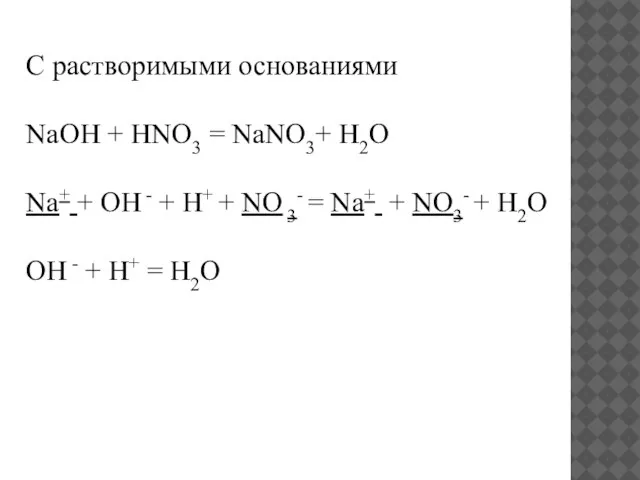
- 10. С растворимыми основаниями NaOH + HNO3 = NaNO3+ H2O Na+ + OH - + H+ +
- 11. C солями (более слабых кислот): Na2CO3 + 2HNO3 = 2NaNO3 + CO2+ H2O 2Na+ + CO32
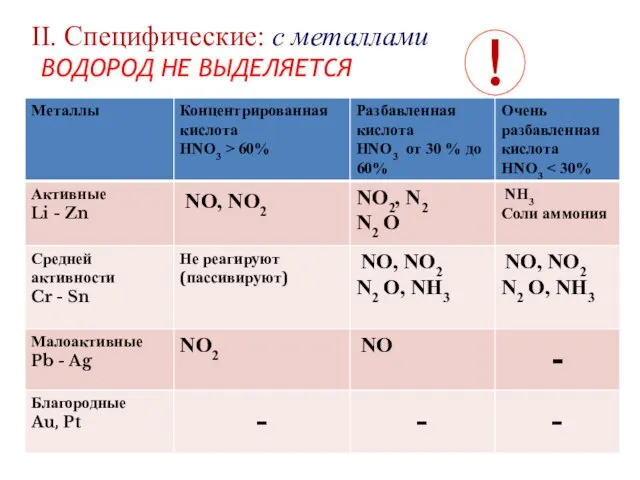
- 12. II. Cпецифические: с металлами ВОДОРОД НЕ ВЫДЕЛЯЕТСЯ !
- 13. Схема уравнения Ме +HNO3 = соль + вода + оксиды азота (нитрат Ме) (аммиак, соли аммония)
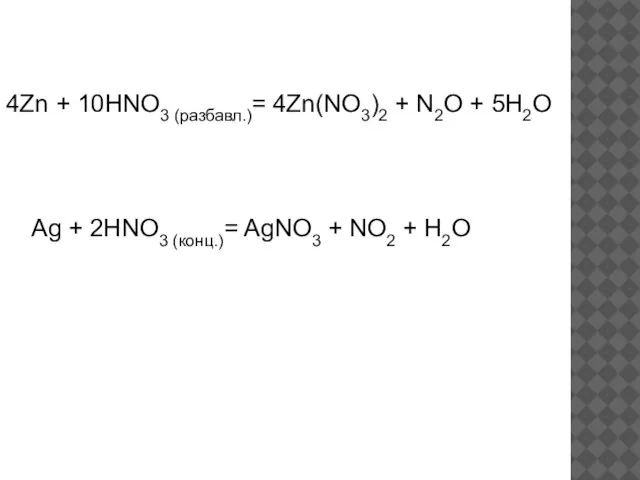
- 14. 4Zn + 10HNO3 (разбавл.)= 4Zn(NO3)2 + N2O + 5H2O Ag + 2HNO3 (конц.)= AgNO3 + NO2
- 15. 4HNO3 = 4 NO2 + 2 H2O + O2.
- 16. Получение ГЛАУБЕР Иоганн Рудольф (1604-1670), немецкий химик и врач. Получил чистую азотную кислоту в 1650 году.
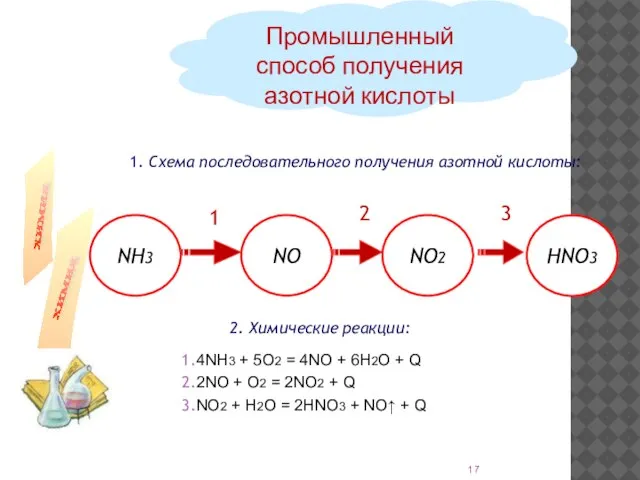
- 17. 1. Схема последовательного получения азотной кислоты: Промышленный способ получения азотной кислоты 2. Химические реакции: 1 2
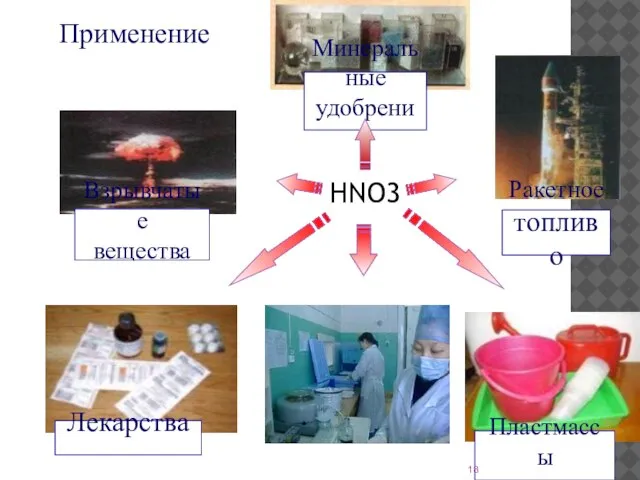
- 18. Применение HNO3
- 19. Согласны ли вы со следующими утверждениями: ? 1. Азотная кислота является сильным окислителем. 2. Азотная кислота
- 20. ПРОВЕРЬ СЕБЯ ! 1. Да 2. Нет 3. Да 4. Нет 5. Нет 6. Да 7.
- 22. Скачать презентацию







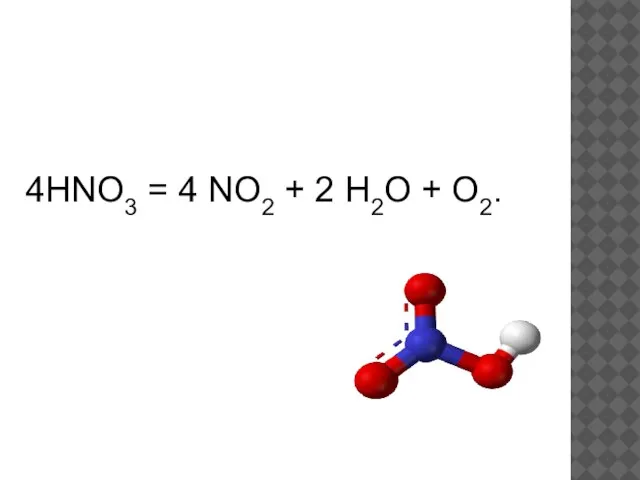



 Кислород. Общая характеристика, получение и свойства
Кислород. Общая характеристика, получение и свойства Презентация на тему Уголь
Презентация на тему Уголь  Кислоты. Строение, классификации и свойства неорганических кислот
Кислоты. Строение, классификации и свойства неорганических кислот Влияние различных факторов на скорость химических реакций
Влияние различных факторов на скорость химических реакций Презентация на тему Биография Д. И. Менделеева
Презентация на тему Биография Д. И. Менделеева  Изомерия
Изомерия Разбор задач
Разбор задач Составление ионных уравнений
Составление ионных уравнений Презентация на тему Фосфор 9 класс
Презентация на тему Фосфор 9 класс  Основы кристаллографии
Основы кристаллографии Решение задач на смеси, растворы и сплавы
Решение задач на смеси, растворы и сплавы Альдегиды и кетоны
Альдегиды и кетоны План для домашней работы по теме Алкадиены
План для домашней работы по теме Алкадиены Строение и свойства металлов
Строение и свойства металлов Презентация на тему Химические свойства бензола. Получение, применение
Презентация на тему Химические свойства бензола. Получение, применение  Кремний и его соединения
Кремний и его соединения Вода. Растворы
Вода. Растворы Органическая химия
Органическая химия Презентация на тему Оксиды
Презентация на тему Оксиды  Периодическая система и периодический закон. Тест
Периодическая система и периодический закон. Тест Витамин C
Витамин C Алюминий
Алюминий Очистка поваренной соли
Очистка поваренной соли Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини
Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини каталитический крекинг
каталитический крекинг Алканы
Алканы Алюміній. Фізичні та хімічні властивості
Алюміній. Фізичні та хімічні властивості Кислоты. Общая формула кислот
Кислоты. Общая формула кислот