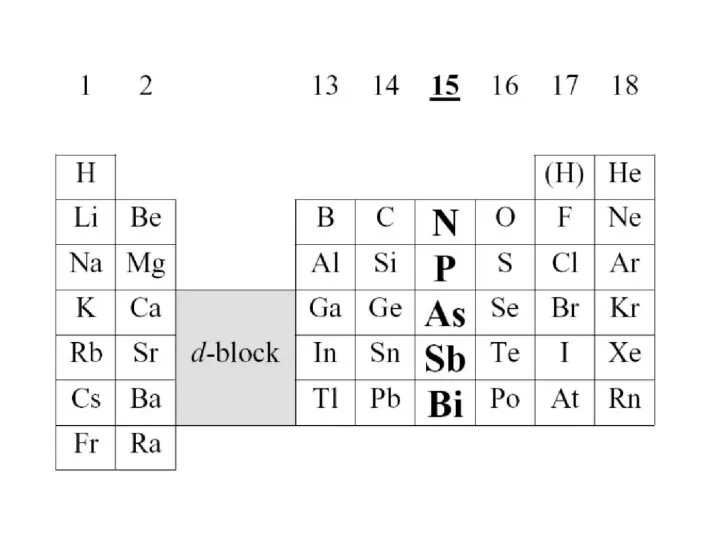
Содержание
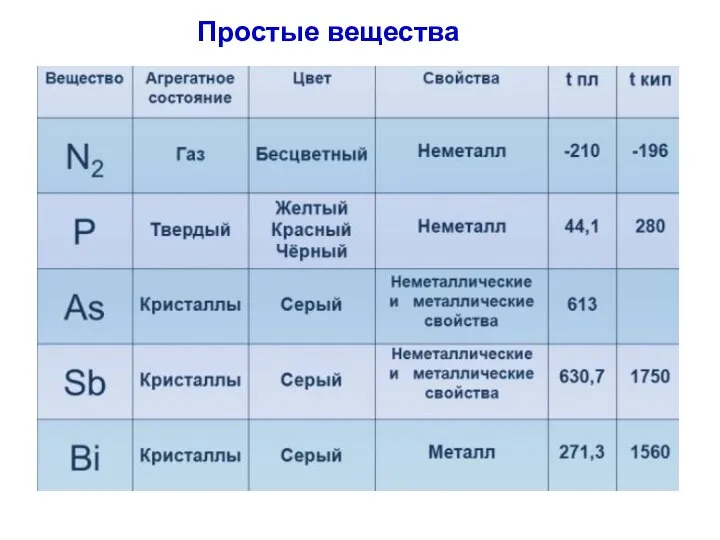
- 3. Простые вещества
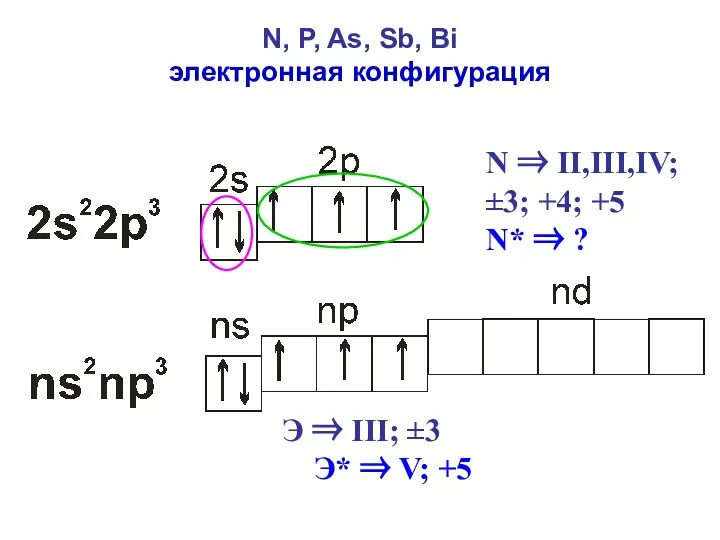
- 4. N, P, As, Sb, Bi электронная конфигурация N ⇒ II,III,IV; ±3; +4; +5 N* ⇒ ?
- 5. Азот: примеры соединений Устойчивые ст. ок.: –3; 0; +5
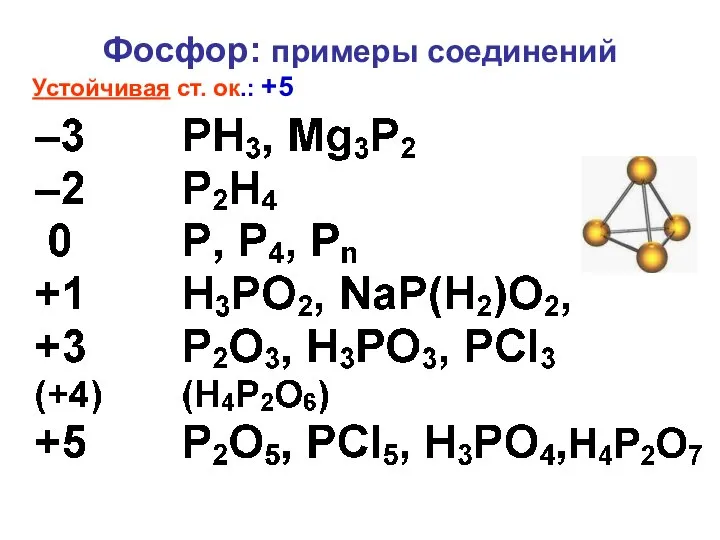
- 6. Фосфор: примеры соединений Устойчивая ст. ок.: +5
- 7. As, Sb, Bi: примеры соединений Устойчивые ст. ок.: +3 As, Bi; +5 Sb
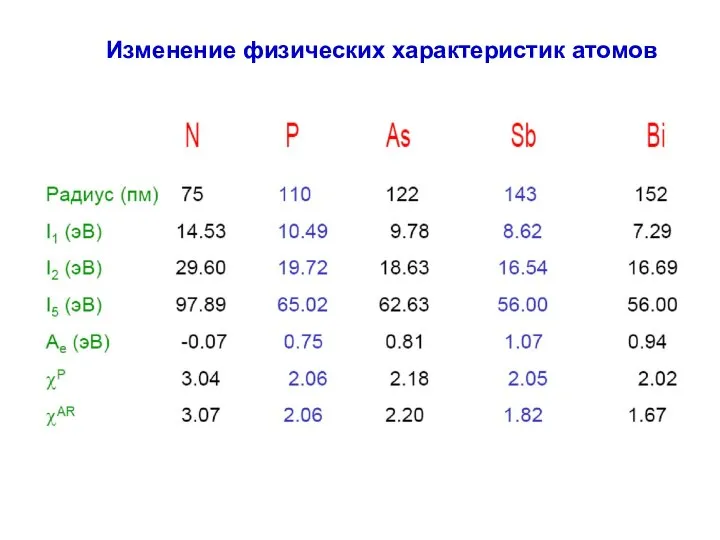
- 8. Изменение физических характеристик атомов
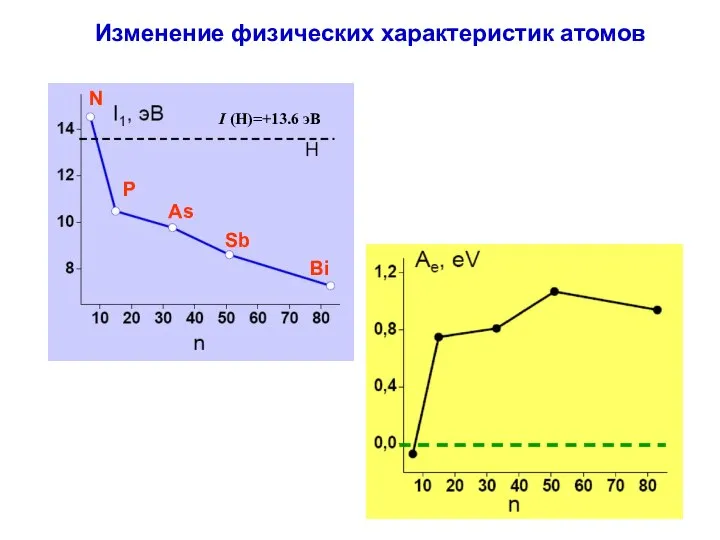
- 9. Изменение физических характеристик атомов N P As Sb Bi I (H)=+13.6 эВ
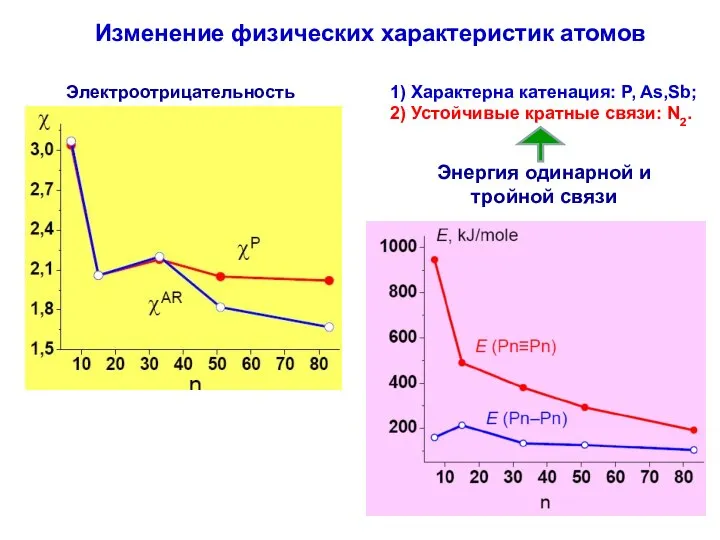
- 10. Изменение физических характеристик атомов Энергия одинарной и тройной связи Электроотрицательность 1) Характерна катенация: P, As,Sb; 2)
- 11. Простые вещества пниктогенов P4 Pn P∞ Asn As4 Sb4 Sbn Bi
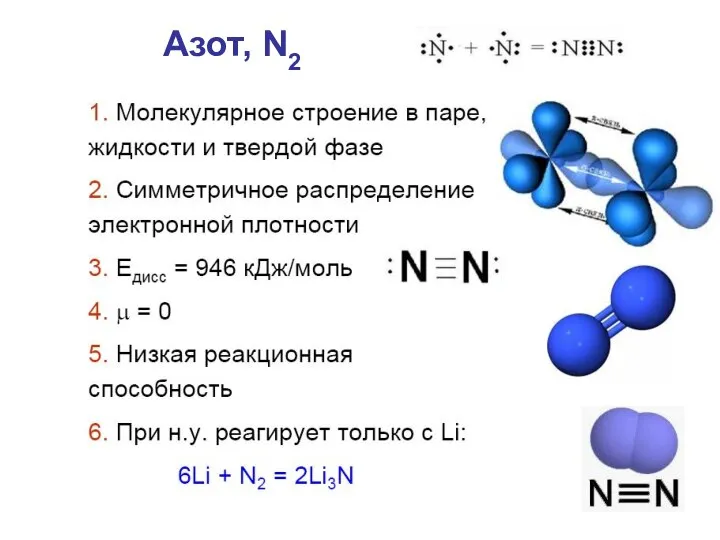
- 12. Азот, N2
- 13. Дополнительно: фиксация N2
- 14. !!!
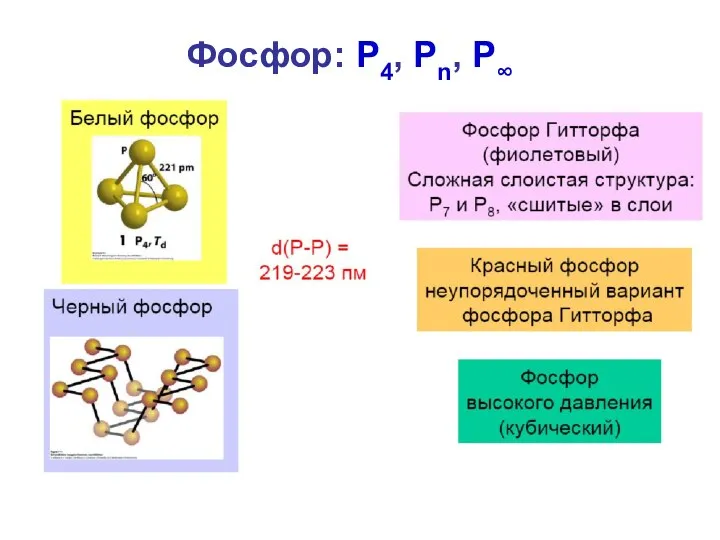
- 15. Фосфор: P4, Pn, P∞
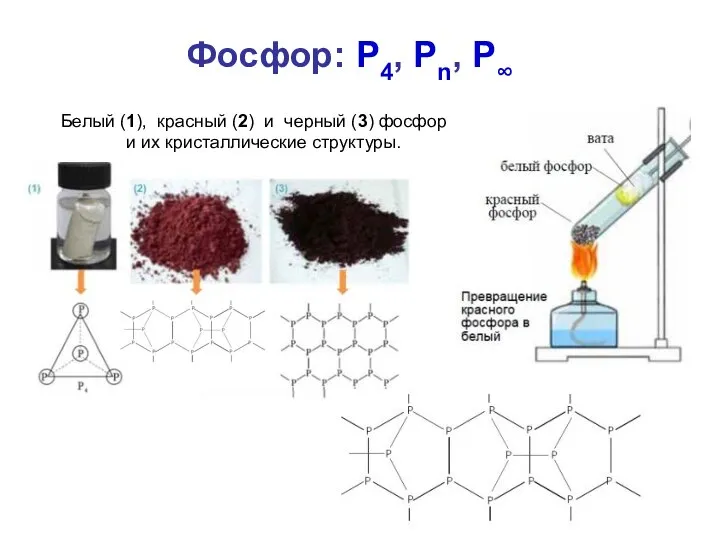
- 16. Фосфор: P4, Pn, P∞ Белый (1), красный (2) и черный (3) фосфор и их кристаллические структуры.
- 17. P4 Pn P∞
- 18. P + O2 → P2O5 + P2O3 (изб. / недост. О2) Хим. свойства фосфора
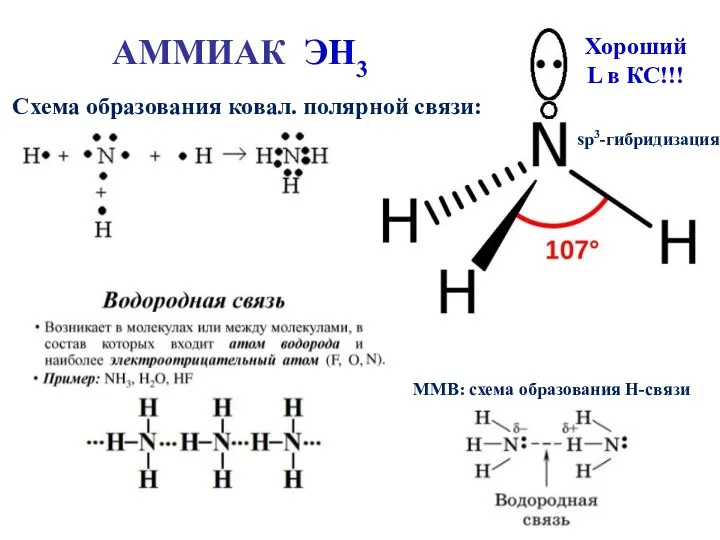
- 20. АММИАК ЭН3 Схема образования ковал. полярной связи: ММВ: схема образования Н-связи sp3-гибридизация Хороший L в КС!!!
- 21. Соединения Э с водородом +1 –1 0 0
- 22. Восстановительная способность ЭН3: Получение гидридов:
- 23. Оксиды азота
- 24. Получение оксидов азота
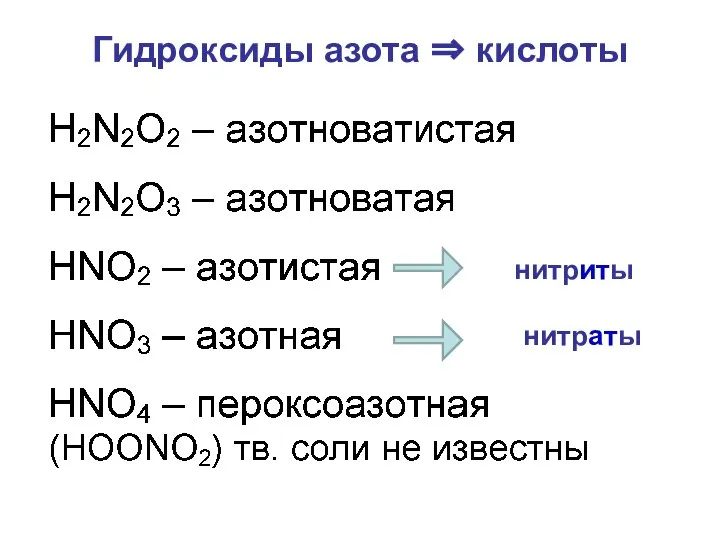
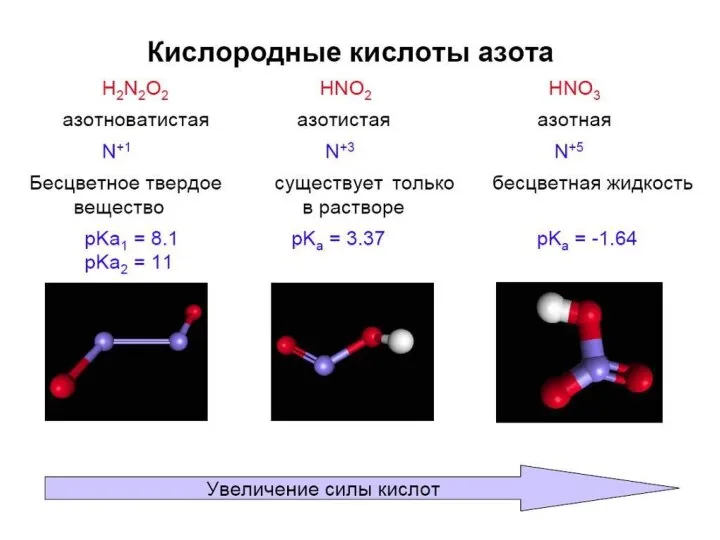
- 25. Гидроксиды азота ⇒ кислоты нитриты нитраты
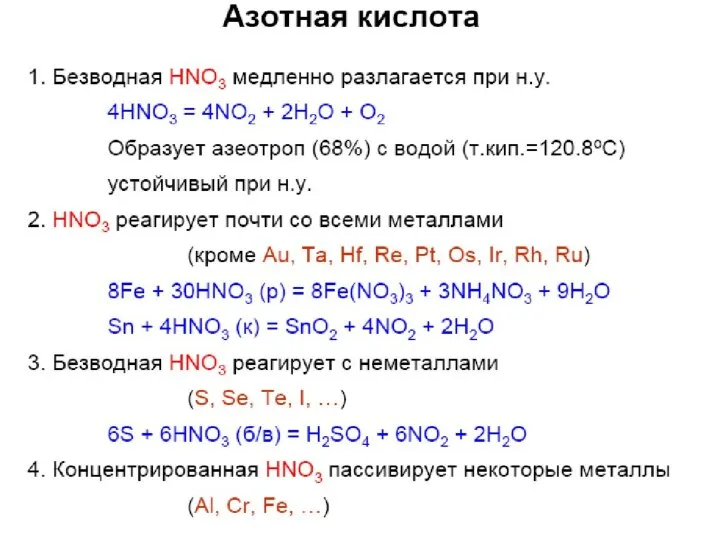
- 27. Особые св-ва азотной кислоты
- 31. Реакции HNO3 с простыми веществами Конц./разб. Продукт восст-я Х зависит от: 1) конц. к-ты; 2) активности
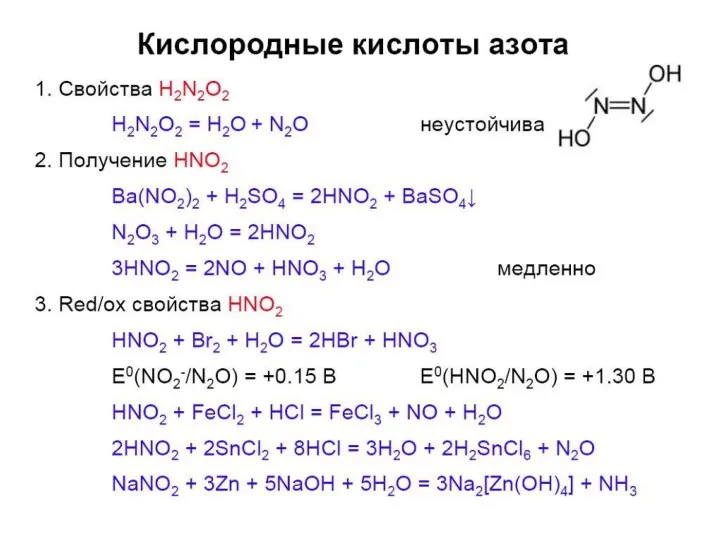
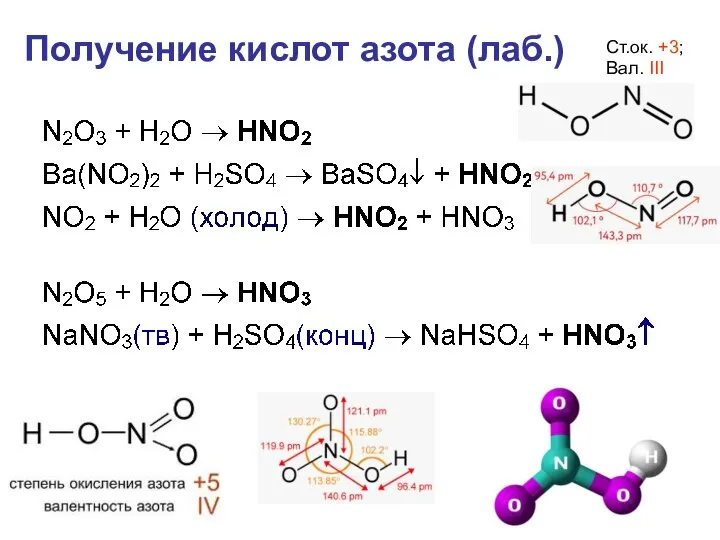
- 32. Получение кислот азота (лаб.) Ст.ок. +3; Вал. III
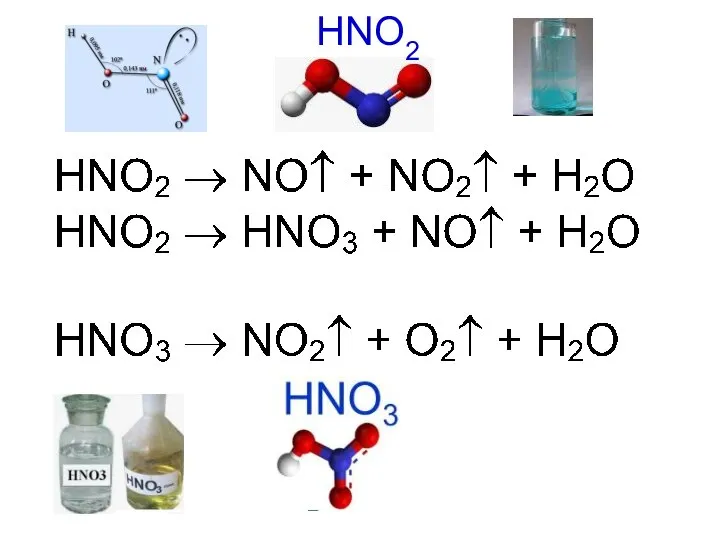
- 33. HNO2
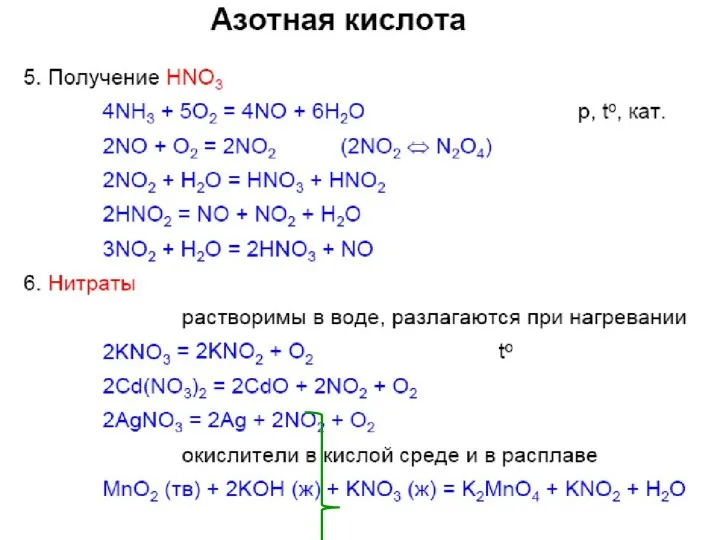
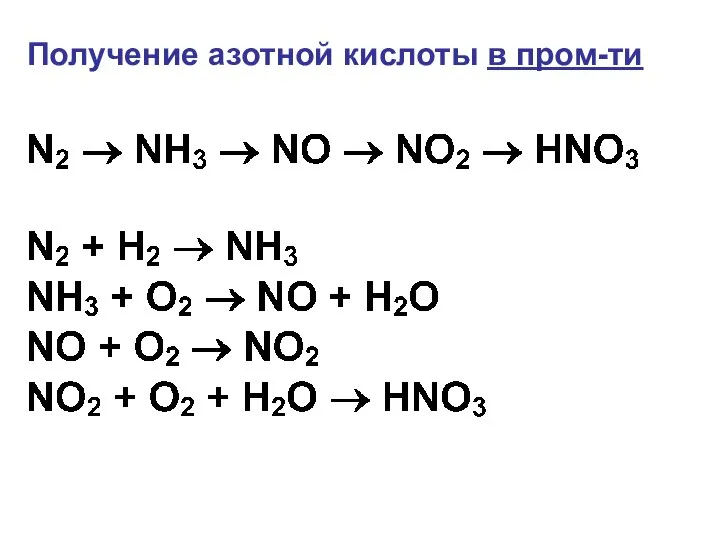
- 34. Получение азотной кислоты в пром-ти
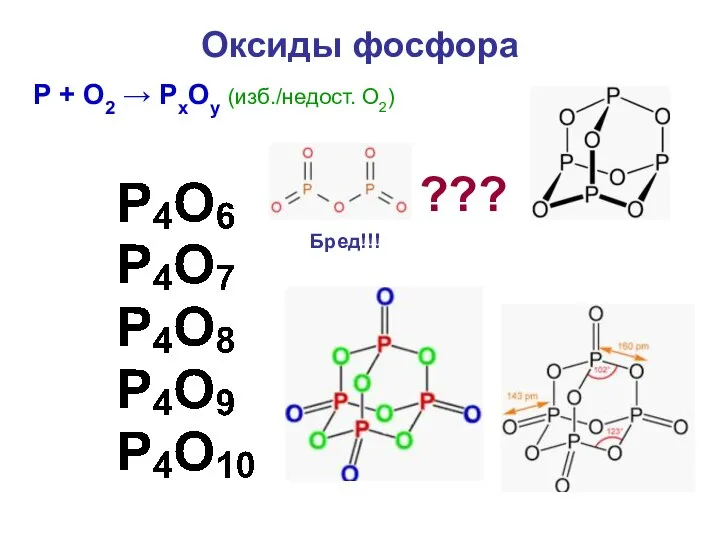
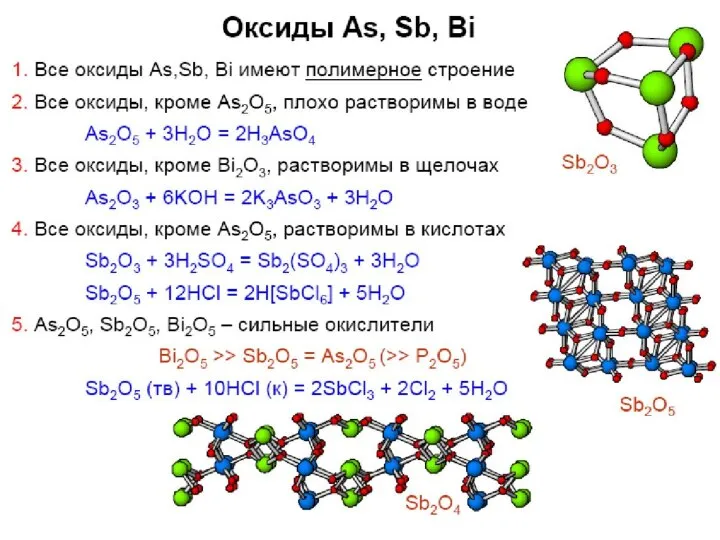
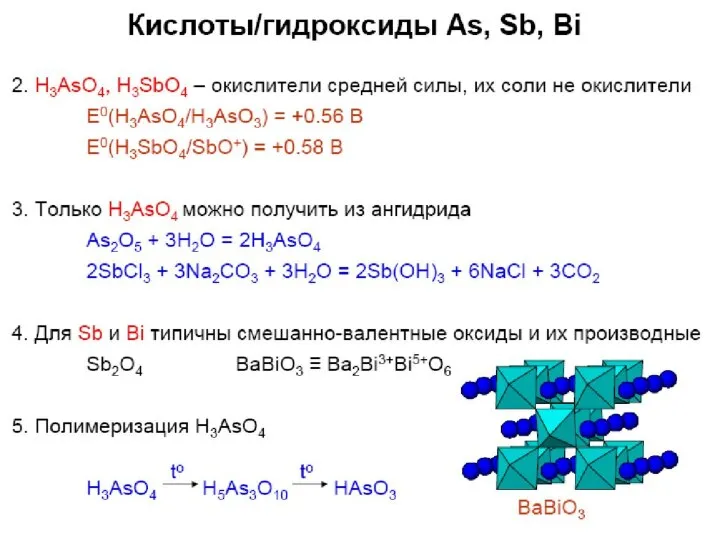
- 35. Оксиды фосфора ??? Бред!!! P + O2 → PхOу (изб./недост. О2)
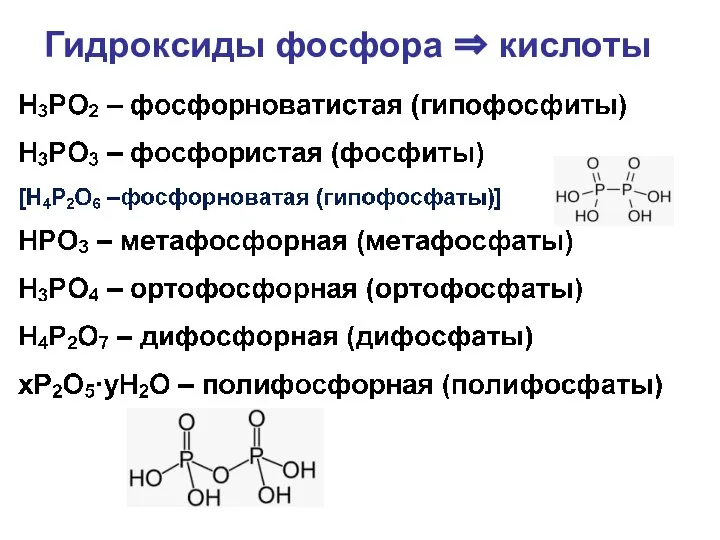
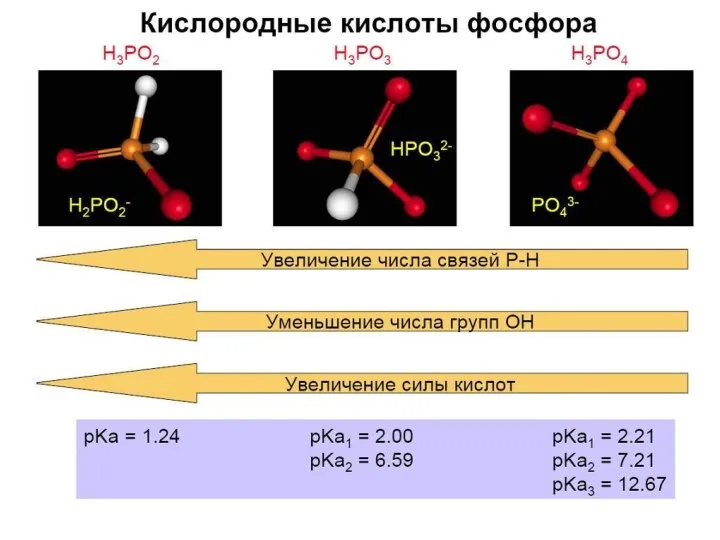
- 36. Гидроксиды фосфора ⇒ кислоты
- 45. Скачать презентацию


















 Презентация на тему В мире индикаторов - исследовательская работа
Презентация на тему В мире индикаторов - исследовательская работа  Бензилиденкетоны в синтезе замещённых бензимидазолопиримидинов
Бензилиденкетоны в синтезе замещённых бензимидазолопиримидинов Мемо-химия. Защита проекта
Мемо-химия. Защита проекта Периодическая система химических элементов. Дмитрий Иванович Менделеев
Периодическая система химических элементов. Дмитрий Иванович Менделеев Химия. Витамин В12
Химия. Витамин В12 Количество вещества - моль
Количество вещества - моль Наноматеріали. Тіт Лукрецій Кар
Наноматеріали. Тіт Лукрецій Кар Плотность вещества
Плотность вещества Турнир знатоков. Интеллектуальная игра
Турнир знатоков. Интеллектуальная игра Презентация на тему Чистые вещества и смеси. Химический диктант
Презентация на тему Чистые вещества и смеси. Химический диктант  Химическая организация клетки
Химическая организация клетки Валентные возможности атомов элементов
Валентные возможности атомов элементов Непредельные углеводороды. Алкадиены. Уроки 22-23
Непредельные углеводороды. Алкадиены. Уроки 22-23 Классификация реакций. Таблица
Классификация реакций. Таблица Получение аминов
Получение аминов Обмен жиров в организме млекопитающего
Обмен жиров в организме млекопитающего Вода. Строение молекулы. Водородная связь. Физические и химические свойства
Вода. Строение молекулы. Водородная связь. Физические и химические свойства Презентация на тему Электролиты
Презентация на тему Электролиты 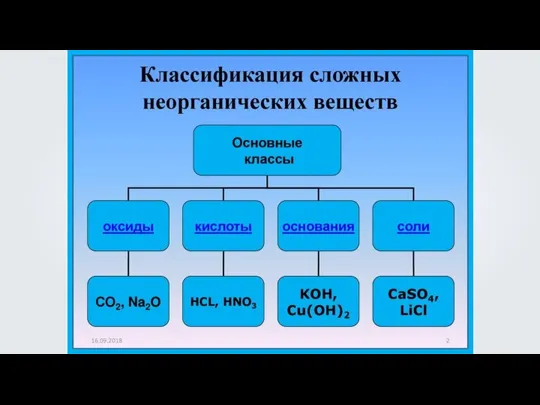 Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Čo sú chemické reakcie
Čo sú chemické reakcie Скорость химической реакции
Скорость химической реакции Glin
Glin Нафтены и арены
Нафтены и арены Действие фермента каталазы на пероксид водорода
Действие фермента каталазы на пероксид водорода ОВР химияПрезентация
ОВР химияПрезентация Алкины. Понятие об алкинах
Алкины. Понятие об алкинах Вспомни… СаО, SО2, Fе2О3 , Nа2О, Сl2О7
Вспомни… СаО, SО2, Fе2О3 , Nа2О, Сl2О7 Синтез метилового эфира цинкофорина
Синтез метилового эфира цинкофорина