Содержание
- 2. Из приведенного перечня определите сильные и слабые электролиты: H2SO4 , Cu (OH)2, H2CO3, K2SO4, Mg(NO3)2, NiOH,
- 3. H2SO4 ⭢ NaOH ⭢ Al2(SO4)3 ⭢ ДИССОЦИАЦИЯ ОСНОВАНИЙ, КИСЛОТ,СОЛЕЙ Na+ + OH- 2H+ + SO42- 2Al3+
- 4. K2CO3 + H2SO4 ? Mg + HCl ? Na2SO4 + Ba(NO3)2? Zn(OH)2 ? NaOH + HCl
- 5. Реакции обмена: K2CO3 + H2SO4 ⭢ Na2SO4 + Ba(NO3) ⭢ NaOH + HCl⭢
- 6. Определите ключевое понятие сегодняшнего урока, используя «лабиринт букв»
- 7. ТЕМА УРОКА: «РЕАКЦИИ ИОННОГО ОБМЕНА»
- 8. Реакции ионного обмена– это ТЕРМИНЫ реакции между ионами. Ионы– это положительно или отрицательно заряженные частицы ?
- 9. Алгоритм составления уравнений реакций ионного обмена
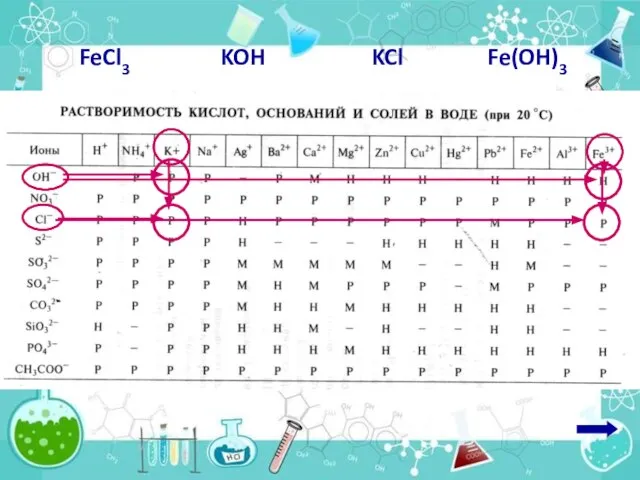
- 10. 1. Записать молекулярное уравнение реакции Даны растворы хлорида железа(III) и гидроксида калия. Написать молекулярное и ионные
- 11. 2. Подчеркнуть сильные электролитов (растворимые соли, 10!!! щелочей и 10!!! кислот)
- 12. FeCl3 KOH Fe(OH)3 KCl
- 13. сильн сильн сильн слаб
- 14. 3. Написать полное ионное уравнение реакции. Fe3+ + + K+ K+ Fe(OH)3 = 3 3 Cl-
- 15. 4. Для составления сокращённого ионного уравнения надо найти одинаковые ионы справа и слева от знака равенства
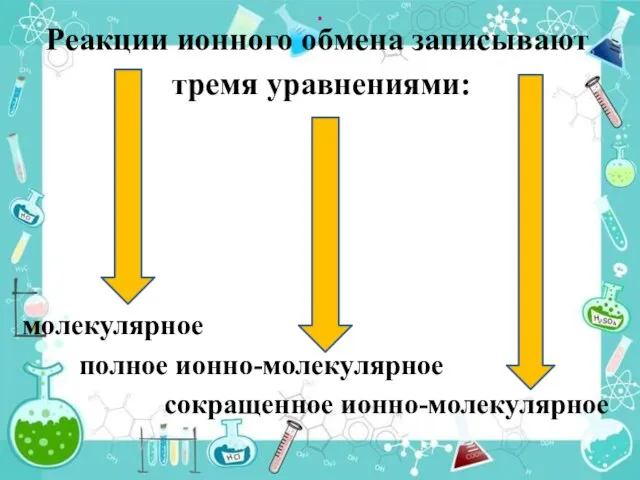
- 16. . Реакции ионного обмена записывают тремя уравнениями: молекулярное полное ионно-молекулярное сокращенное ионно-молекулярное
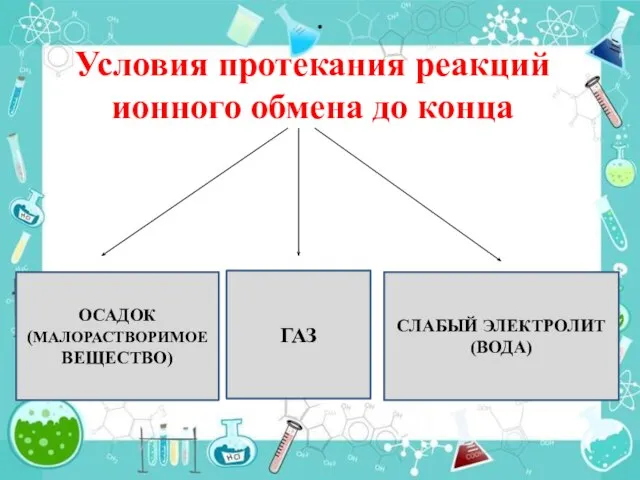
- 17. ПРИЗНАКИ ПРОТЕКАНГИЯ РЕАКЦИИ ИОННОГО ОБМЕНА
- 18. Задание № 1 ВЫДЕЛЕНИЕ ГАЗА Молекулярное уравнение : Na2CO3 + 2HCl = 2NaCl + H2O +
- 19. Задание № 2. ВЫПАДЕНИЕ ОСАДКА Молекулярное уравнение : CuCl2 + 2NaOH → 2NaCl + Cu(OH)2↓ Полное
- 20. Задание № 3 ОБРАЗОВАНИЕ ВОДЫ Молекулярное уравнение реакции щелочи с кислотой: NaOH + HCl → NaCl
- 21. Как называется реакция взаимодействия сильной кислоты с щелочью?
- 22. Реакция нейтрализации
- 23. Задание № 4 ПРИЗНАКОВ НЕ НАБЛЮДАЕТСЯ Молекулярное уравнение: NaOH + KCl → NaCl + KOH Полное
- 24. . ОСАДОК (МАЛОРАСТВОРИМОЕ ВЕЩЕСТВО) ГАЗ СЛАБЫЙ ЭЛЕКТРОЛИТ (ВОДА) Условия протекания реакций ионного обмена до конца
- 25. Тест «Проверь себя»: 1) Ионные реакции – это реакции между: а) нейтральными атомами б) ионами в)
- 26. . 4) Какое вещество надо добавить к соляной кислоте, чтобы в результате реакции выделился газ: а)
- 27. Ответы: 1. б 2. а 3. а 4. в 5. г
- 28. РЕФЛЕКСИЯ - Cегодня на уроке я научилась(ся)…… - Мне было легко… Мне было сложно… Особенно интересным
- 30. Скачать презентацию
























 Химические растворы
Химические растворы Оборудование и реактивы
Оборудование и реактивы Изотопы. Области применения изотопов
Изотопы. Области применения изотопов Гальванические элементы
Гальванические элементы Общая химическая технология. Тепловой (энергетический) баланс. Практическое занятие 7
Общая химическая технология. Тепловой (энергетический) баланс. Практическое занятие 7 Химия и автомобиль
Химия и автомобиль Составление уравнений химических реакций. Решение упражнений по теме
Составление уравнений химических реакций. Решение упражнений по теме Алканы
Алканы Электронная структура атомов
Электронная структура атомов Карбоксилденген этоксилаттар
Карбоксилденген этоксилаттар Коллоидные растворы
Коллоидные растворы Железо
Железо Композитные материалы
Композитные материалы Создание учебно-методических материалов по химии в современной форме (презентации уроков)
Создание учебно-методических материалов по химии в современной форме (презентации уроков) ad8c00e7ea114b35a6fc29426ea31646 (1)
ad8c00e7ea114b35a6fc29426ea31646 (1) Углеводороды: номенклатура
Углеводороды: номенклатура Химические реакции
Химические реакции MPKh_PREZENTATsIYa_2
MPKh_PREZENTATsIYa_2 Щелочноземельные металлы
Щелочноземельные металлы Электролиты. Химический диктант (9 класс)
Электролиты. Химический диктант (9 класс) Применение брома
Применение брома Получение антибиотиков
Получение антибиотиков 20.10. Презентация _Химическая связь и её типы_ 11 класс
20.10. Презентация _Химическая связь и её типы_ 11 класс Коллоидные системы Классификация. Получение. Очистка. Свойства. Устойчивость и коагуляция. Применение
Коллоидные системы Классификация. Получение. Очистка. Свойства. Устойчивость и коагуляция. Применение Алюминий и его соединения
Алюминий и его соединения Презентация на тему Природные и синтетические красители и ароматизаторы
Презентация на тему Природные и синтетические красители и ароматизаторы  Всё о нефти. Часть 5
Всё о нефти. Часть 5 Електролітична дисоціація
Електролітична дисоціація