Содержание
- 2. Ионная сила раствора – мера интенсивности электрического поля, создаваемого ионами. Равна полусумме произведений концентрации ионов на
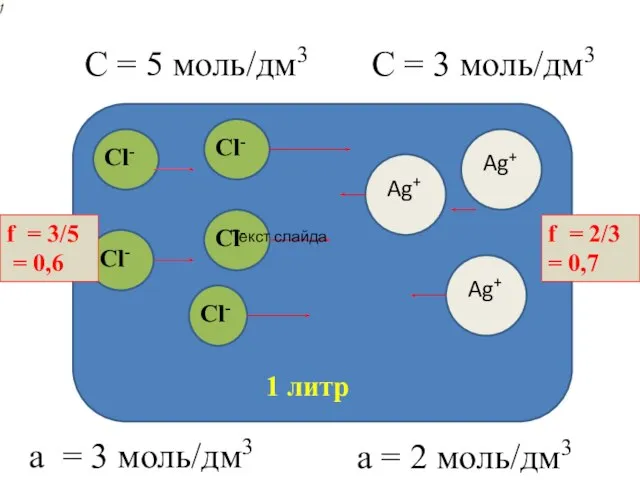
- 3. Например, для раствора NaCl с концентрацией 0,001 моль/л, в котором присутствуют два вида однозарядных ионов Na+
- 4. 1 литр Сl- Сl- Сl- Сl- Сl- C = 5 моль/дм3 Ag+ Ag+ Ag+ С =
- 6. Закон действующих масс и гомогенные системы
- 7. Закон действующих масс ‒ основной закон для химического равновесия Значит и один из ведущих в аналитической
- 8. Пример: для реакции аА + вВ = сС + dD математическим выражением закона действующих масс для
- 9. Можно рассмотреть практически любую реакцию, лежащую в основе химического анализа, или вспомогательную, – все будут описаны
- 10. Закон действующих масс в 1864–1867 гг. установили норвежские ученые: математик и физико-химик Като Максимилиан Гультберг и
- 11. ЗДМ применим к процессам диссоциации Диссоциировать могут как слабые электролиты, так и сильные. Cилу электролита характеризует
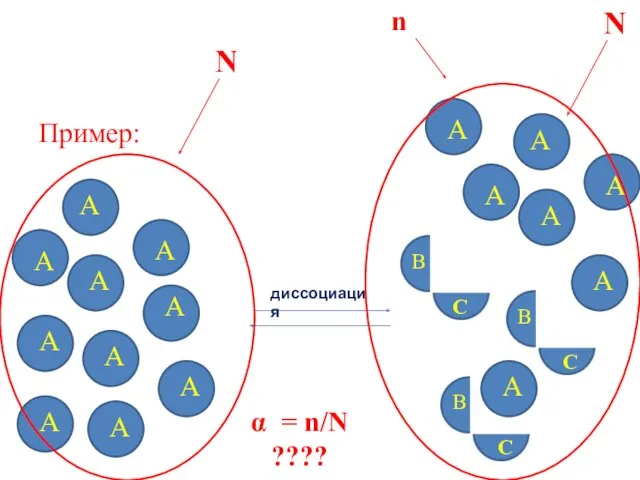
- 12. Пример: А А А А А А А А А А диссоциация В С В С
- 13. При исследовании большого числа электролитов было установлено, что ЗДМ применим только к слабым электролитам
- 14. Ионное произведение воды
- 15. Ионное произведение воды · (-1)
- 16. Например, для раствора НCl с концентрацией 0,001 моль/л, в котором присутствуют два вида однозарядных ионов Н+
- 17. Например, для раствора СН3СOOH с концентрацией 0,001 моль/л, в котором присутствуют два вида однозарядных ионов Н+
- 18. ПРИМЕНЕНИЕ ЗАКОНА ДЕЙСТВУЮЩИХ МАСС К КИСЛОТНО-ОСНОВНЫМ БУФЕРНЫМ СИСТЕМАМ Буферные растворы – это растворы, поддерживающие определенное значение
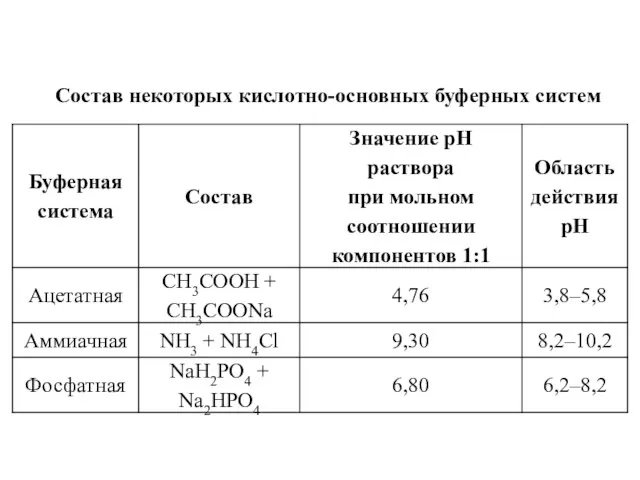
- 19. Состав некоторых кислотно-основных буферных систем
- 20. Механизм действия буферных систем Пример: при добавлении к ацетатному буферному раствору небольшого количества гидроксида натрия NaOH
- 21. Механизм действия буферных систем Если добавить избыток кислоты, то в сохранении состояния будет играть роль другой
- 22. Вычисление рН буферных растворов Вычисление pH буферных растворов, образованных слабой кислотой и ее солью
- 23. Вычисление рН буферных растворов Вычисление pH буферных растворов, образованных слабым основанием и ее солью
- 25. Скачать презентацию



















 Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Ароматические нитросоединения
Ароматические нитросоединения Несовершенства и дефекты кристаллической решетки полимеров
Несовершенства и дефекты кристаллической решетки полимеров Никель и его соединения
Никель и его соединения Основные классы неорганических веществ
Основные классы неорганических веществ Комплексные соединения
Комплексные соединения Структура металлов, сплавов, интерметаллидов и квазикристаллов
Структура металлов, сплавов, интерметаллидов и квазикристаллов Степень окисления. Электроотрицательность. Формулы бинарных соединений
Степень окисления. Электроотрицательность. Формулы бинарных соединений Презентация на тему Изомерия
Презентация на тему Изомерия  Фосфолипиды. Глицерофосфолипиды. Сфингофосфолипиды. Гликолипиды
Фосфолипиды. Глицерофосфолипиды. Сфингофосфолипиды. Гликолипиды Оксид цинка ZnO
Оксид цинка ZnO Расчётно-графическая работа по теме Мыловарение
Расчётно-графическая работа по теме Мыловарение Биохимия витаминов и коферментов
Биохимия витаминов и коферментов Применение алкенов
Применение алкенов Химические реакции в органической химии
Химические реакции в органической химии Презентация на тему Теория строения органических соединений А. М. Бутлерова
Презентация на тему Теория строения органических соединений А. М. Бутлерова  Энергия Гиббса
Энергия Гиббса Получение армированных фотополимерных композиций
Получение армированных фотополимерных композиций Алканы
Алканы Химия. Зачем она нужна? Дистанционный конкурс «Химия без лаборатории» Ученица 10 класса Климашина Василиса, ГОУСОШ № 464 – ЦАО, г. М
Химия. Зачем она нужна? Дистанционный конкурс «Химия без лаборатории» Ученица 10 класса Климашина Василиса, ГОУСОШ № 464 – ЦАО, г. М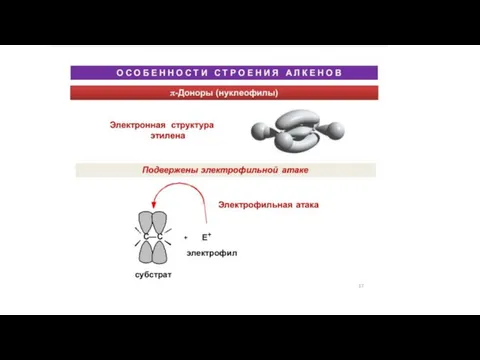 Особенности строения алкенов
Особенности строения алкенов Получение функциональных плёнок на основе TiO2
Получение функциональных плёнок на основе TiO2 Сколько нужно чистого белка
Сколько нужно чистого белка Дивный мир турмалинов
Дивный мир турмалинов Кислородсодержащие органические вещества
Кислородсодержащие органические вещества Эмульсии как лиофобные дисперсные системы
Эмульсии как лиофобные дисперсные системы Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия
Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия Презентация по Химии "Незнайка в стране химия"
Презентация по Химии "Незнайка в стране химия"