Содержание
- 2. Типы окислительно-восстановительных реакций Межмолекулярные окислительно- восстановительные реакции Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2 + 2H2O
- 3. Внутримолекулярные окислительно-восстановительные реакции Типы окислительно-восстановительных реакций (NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O -3 0 +6
- 4. Типы окислительно-восстановительных реакций Реакция диспропорционирования (самоокисления – самовосстановления) +5 -1 +7
- 5. Реакция конпропорционирования (репропорционирования) Типы окислительно-восстановительных реакций 5NaBr + NaBrO3 + 3H2SO4 = 3Br2 + 3Na2SO4 +3H2O
- 6. Направление окислительно-восстановительных реакций ΔE = -ΔG/nF ∆G= -nF·ΔE ΔE = φокислителя - φвосстановителя
- 7. Направление окислительно-восстановительных реакций ΔE = -ΔG/nF ∆G= -nF·ΔE ΔE = φокислителя - φвосстановителя Процесс возможен, если
- 8. Направление окислительно-восстановительных реакций ΔE = -ΔG/nF ∆G = -nF·ΔE ΔE характеризует полуреакцию восстановления окислителя и называется
- 9. Таблица стандартных окислительно-восстановительных потенциалов
- 10. Определим возможность окисления бромом Fe2+ до Fe3+
- 11. Определим возможность окислить ионом Fe3+ CI -, Br - ,J -
- 12. Уравнение Нернста В. Нернст (1864-1941)
- 13. Влияние среды на величину потенциала Потенциал тем больше, чем кислее раствор
- 14. Формы представления потенциалов 1. Таблица
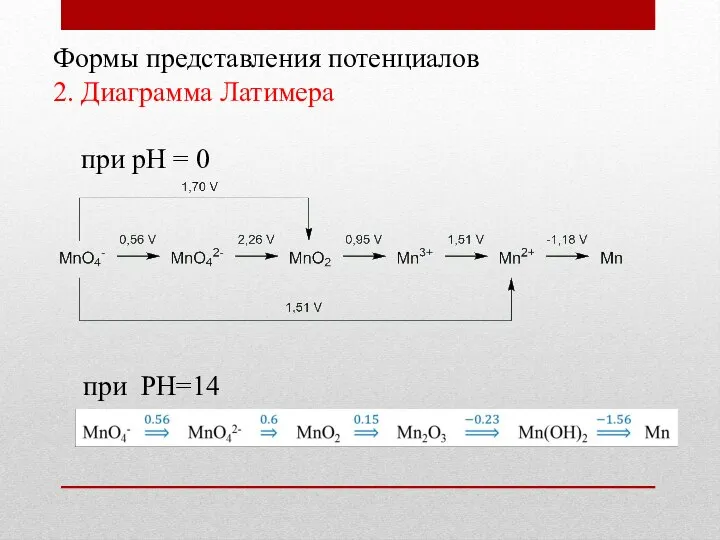
- 15. Формы представления потенциалов 2. Диаграмма Латимера при рН = 0 при РН=14
- 16. Формы представления потенциалов 2. Диаграмма Латимера при рН = 0 а)Расчет потенциала окислительно-восстановительной пары +7 +4
- 17. Формы представления потенциалов 2. Диаграмма Латимера при рН = 0 б) Определение возможности реакции диспропорционирования Процесс
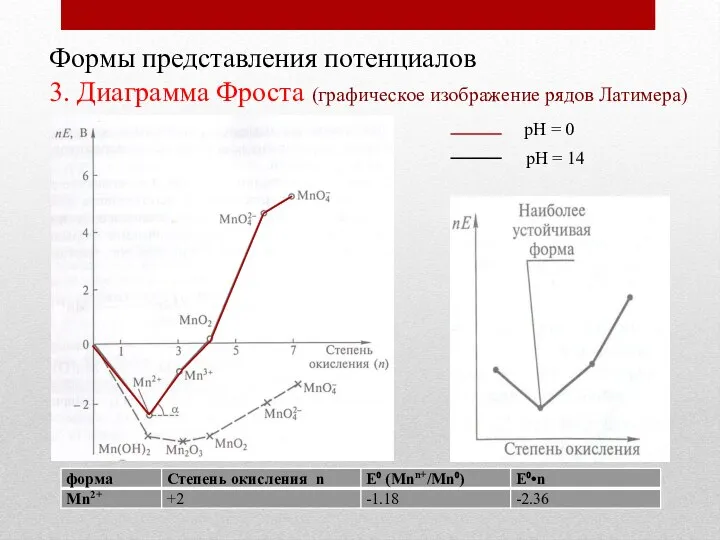
- 18. Формы представления потенциалов 3. Диаграмма Фроста (графическое изображение рядов Латимера) рН = 0 рН = 14
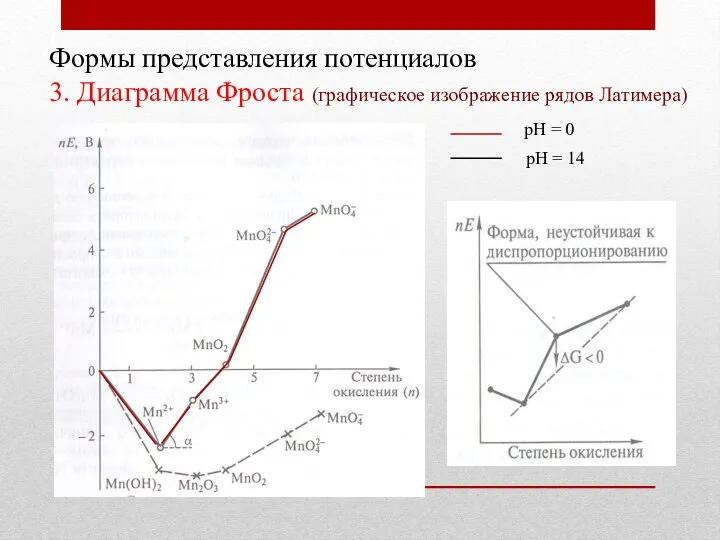
- 19. Формы представления потенциалов 3. Диаграмма Фроста (графическое изображение рядов Латимера) рН = 0 рН = 14
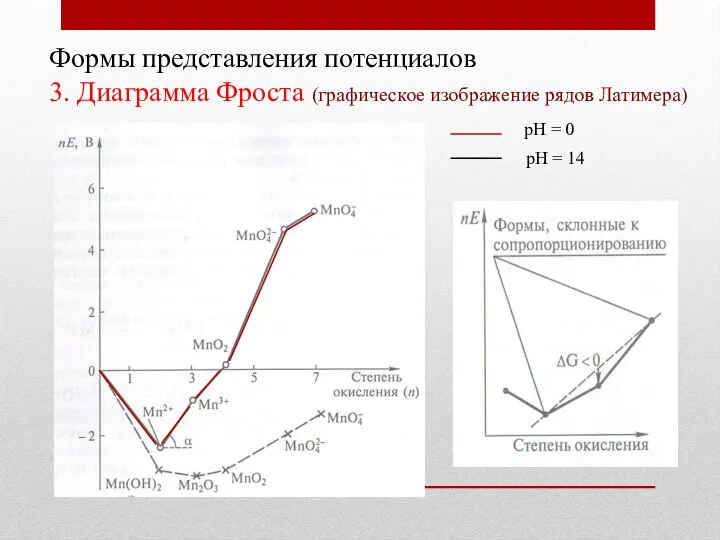
- 20. Формы представления потенциалов 3. Диаграмма Фроста (графическое изображение рядов Латимера) рН = 0 рН = 14
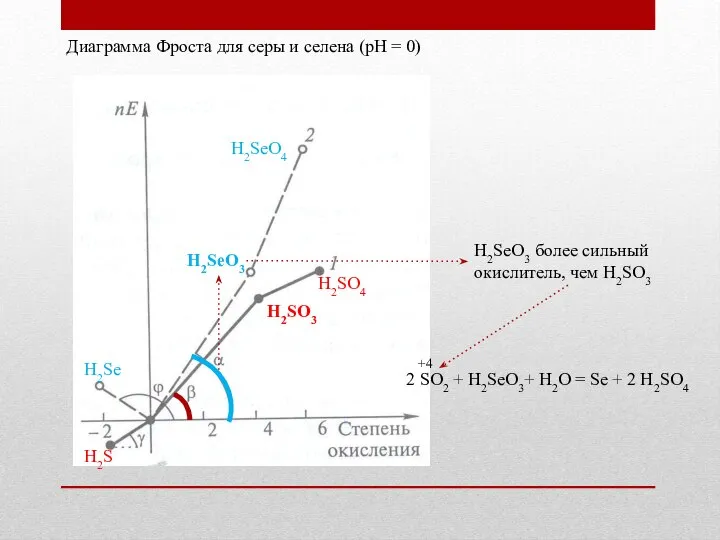
- 21. Диаграмма Фроста для серы и селена (рН = 0) + H2SeO4 H2SeO3 H2Se H2SO4 H2SO3 H2S
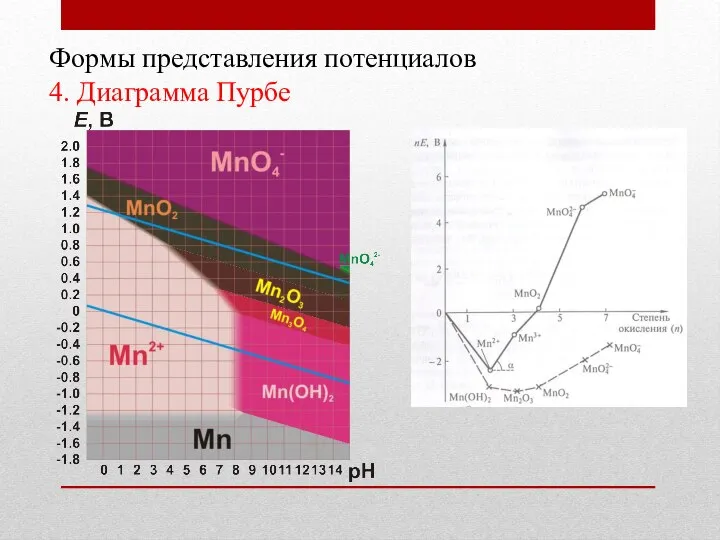
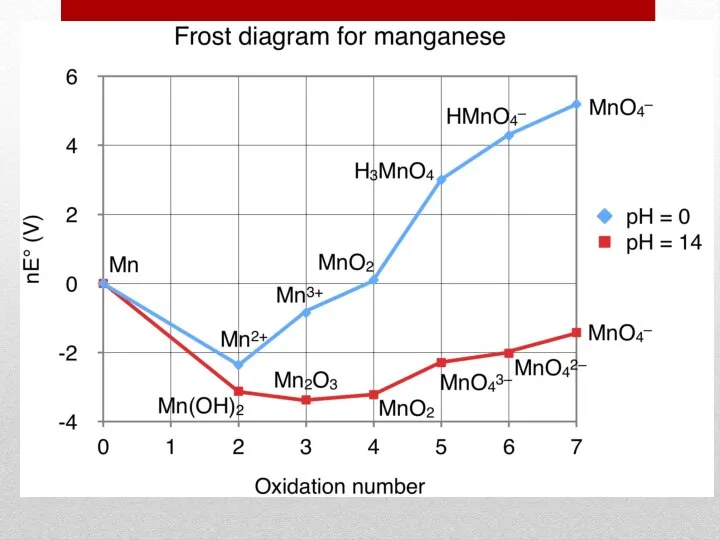
- 22. Формы представления потенциалов 4. Диаграмма Пурбе
- 24. К.т.н., доцент Рогалева Елена Валерьевна Российский Государственный Университет нефти и газа имени И. М. Губкина Кафедра
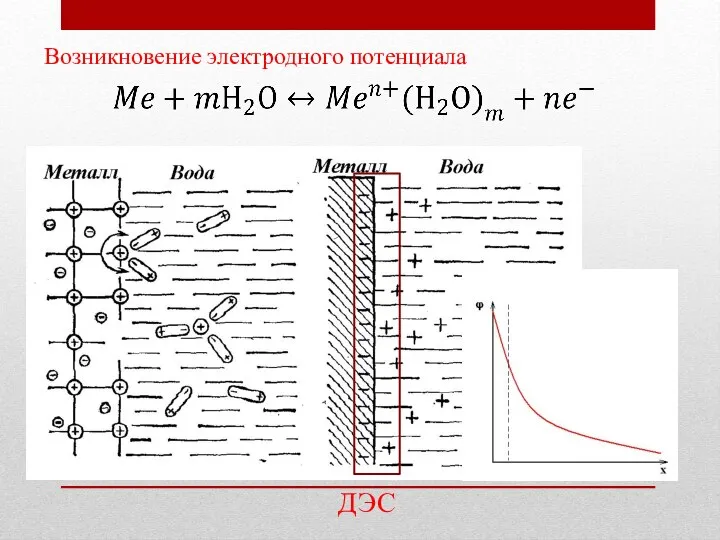
- 25. Возникновение электродного потенциала ДЭС
- 26. Стандартный водородный электрод 2- платиновая пластина, покрытая высокодисперсной платиной (платиновой чернью); 5 - 1 М раствор
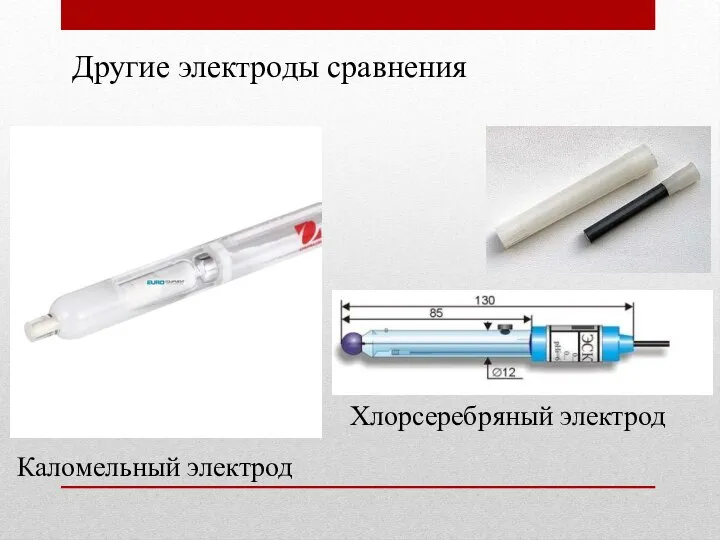
- 27. Каломельный электрод Хлорсеребряный электрод Другие электроды сравнения
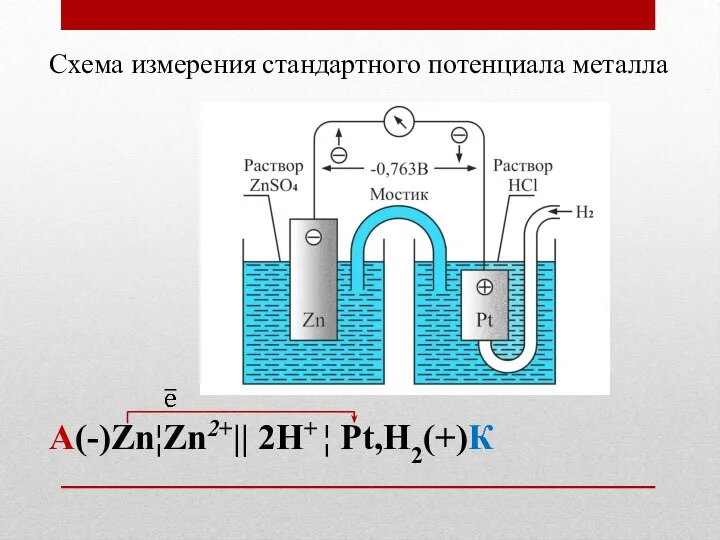
- 28. Схема измерения стандартного потенциала металла А(-)Zn¦Zn2+|| 2H+ ¦ Pt,H2(+)К
- 29. Схема измерения стандартного потенциала металла А(-)Zn¦Zn2+|| 2H+ ¦ Pt,H2(+)К (-) А Zn - 2e → Zn2+
- 30. Ряд активности металлов Н. Н. Бекетов (1827-1911)
- 31. Гальванические элементы
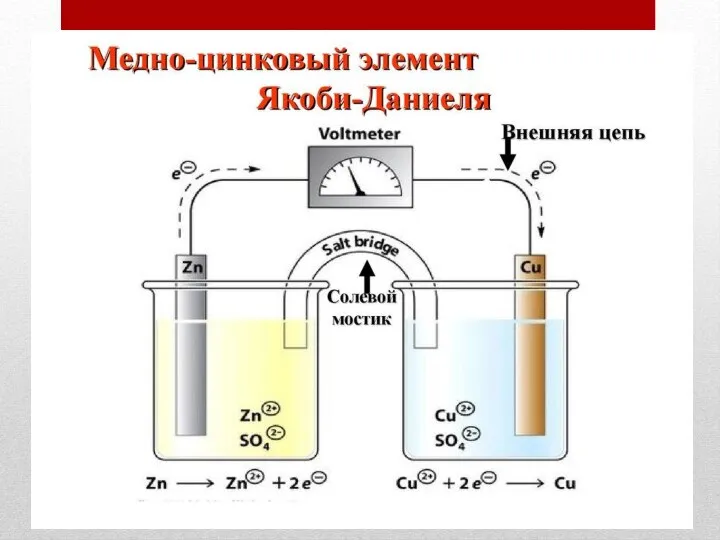
- 32. Гальванические элементы на аноде: на катоде: Полная схема ГЭ А(-)Zn¦ZnSO4||CuSO4 ¦ Cu(+)К E (ЭДС) = φк
- 33. Гальванические элементы Концентрационный элемент Уравнение Нернста
- 34. Батареи и промышленные источники тока Сухой гальванический элемент Ж. Лекланше Ж. Лекланше (1839-1882)
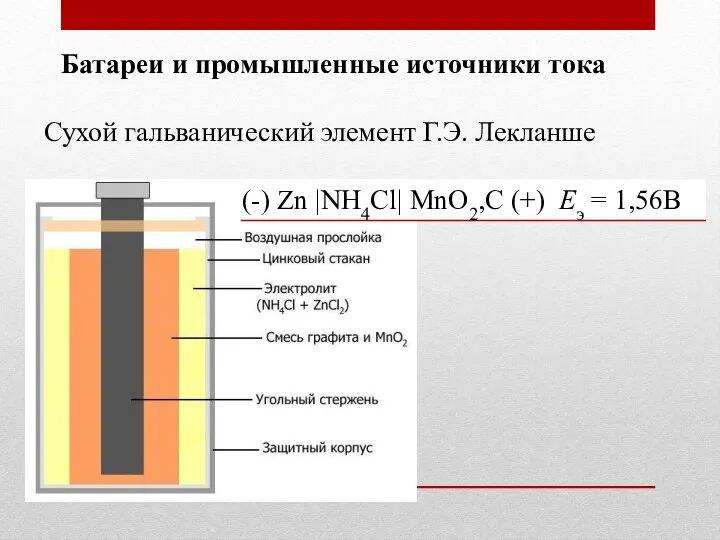
- 35. Батареи и промышленные источники тока Сухой гальванический элемент Г.Э. Лекланше (-) Zn |NH4Cl| MnO2,C (+) Eэ
- 36. Батареи и промышленные источники тока Сухой гальванический элемент Г.Э. Лекланше (-) Zn |NH4Cl| MnO2,C (+) Eэ
- 37. Батареи и промышленные источники тока
- 38. Батареи и промышленные источники тока Аккумуляторы. Свинцовый аккумулятор Pb |H2SO4| PbO2 , ЭДС≈ 2В
- 39. Батареи и промышленные источники тока Аккумуляторы. Свинцовый аккумулятор На аноде: Pb(тв.) + SO42-(водн.) - 2e- =
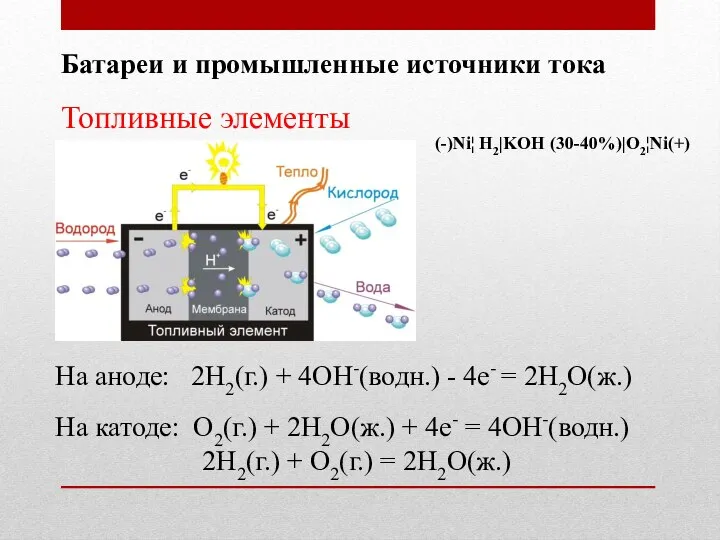
- 40. Батареи и промышленные источники тока Топливные элементы На катоде: O2(г.) + 2H2O(ж.) + 4e- = 4OH-(водн.)
- 41. Батареи и промышленные источники тока Топливные элементы
- 43. Скачать презентацию


























 Хлорорганические соединения
Хлорорганические соединения 8-12 химические реакции
8-12 химические реакции Силумины. Виды силуминов
Силумины. Виды силуминов Побочная подгруппа VIII группы
Побочная подгруппа VIII группы Присоединение диарилфосфинитов к а-имидоакрилатам
Присоединение диарилфосфинитов к а-имидоакрилатам Медь
Медь Презентация на тему Полимеразная цепная реакция (ПЦР)
Презентация на тему Полимеразная цепная реакция (ПЦР)  Презентация на тему Химия наука о веществах
Презентация на тему Химия наука о веществах  Простые и сложные вещества
Простые и сложные вещества Мезомерный эффект
Мезомерный эффект Активность каталазы
Активность каталазы Ковалентная связь между одинаковыми атомами неметаллов
Ковалентная связь между одинаковыми атомами неметаллов Жиры. Техническая переработка жиров
Жиры. Техническая переработка жиров Методы изготовления из резины и латекса
Методы изготовления из резины и латекса Важнейшие породообразующие минералы
Важнейшие породообразующие минералы Алканы. Строение
Алканы. Строение Электролитическая диссоциация
Электролитическая диссоциация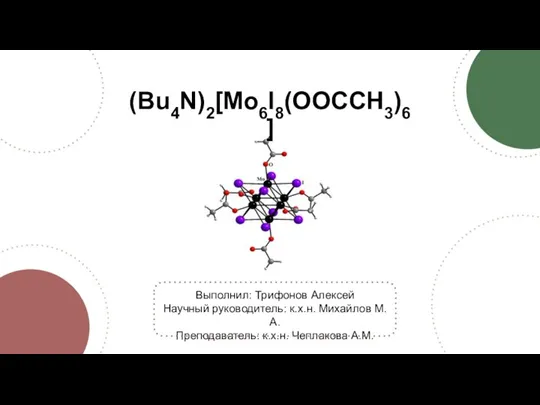 (Bu4N)2[Mo6I8(OOCCH3)6]. Синтез
(Bu4N)2[Mo6I8(OOCCH3)6]. Синтез Химические системы. Химическая термодинамика. Химическое равновесие
Химические системы. Химическая термодинамика. Химическое равновесие Атомно-емісійна спектрометрія з індуктивно-зв’язаною плазмою та рентгенофлуоресцентний аналіз
Атомно-емісійна спектрометрія з індуктивно-зв’язаною плазмою та рентгенофлуоресцентний аналіз Презентация на тему Классификация химических реакций
Презентация на тему Классификация химических реакций  Классы неорганических соединений
Классы неорганических соединений Реакции, подтверждающие взаимосвязь различных
Реакции, подтверждающие взаимосвязь различных Область применения карбоновых кислот
Область применения карбоновых кислот Получение галогенов. Биологическое значение и применение галогенов и их соединений
Получение галогенов. Биологическое значение и применение галогенов и их соединений Метод МО Хюккеля (МОХ)
Метод МО Хюккеля (МОХ) Сопротивление материалов коррозии
Сопротивление материалов коррозии Periodická soustava prvků
Periodická soustava prvků