Содержание
- 2. Химия – наука о веществах, их строении, свойствах и превращениях. Химические свойства веществ – это способность
- 3. Атомно – молекулярное учение. Михаил Васильевич Ломоносов (1711 – 1765) Джон Дальтон (1766 – 1844) Учение
- 4. Основные положения атомно – молекулярного учения. Вещества состоят из молекул. Молекула - это наименьшая частица вещества,
- 5. 3. Вещества, молекулы которых состоят из атомов одного элемента простые вещества. Вещества, молекулы которых состоят из
- 6. Периодический закон – фундаментальный закон химии. В 1869 году Д. И. Менделеевым был сформулирован Периодический закон.
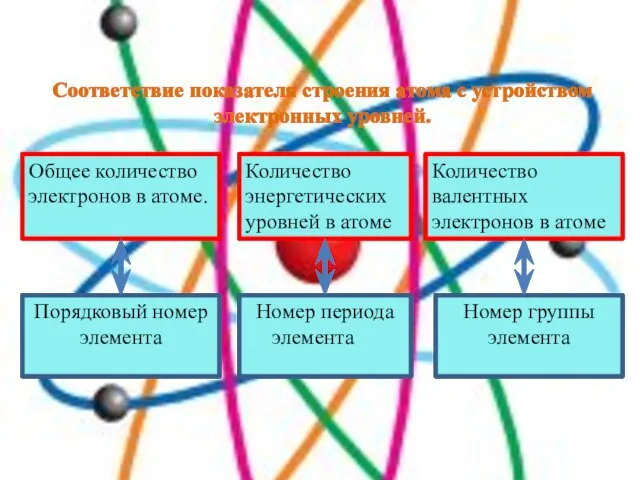
- 7. Соответствие показателя строения атома с устройством электронных уровней. Общее количество электронов в атоме. Порядковый номер элемента
- 8. Закон постоянства состава веществ. Жозеф Луи Пруст (1754 – 1826) Закон был открыт французским ученым в
- 9. Закон сохранения массы вещества. Антуан Лоран Лавуазье (1743 – 1794) Михаил Васильевич Ломоносов (1711 -1765) Закон
- 10. « Все перемены в натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимается,
- 11. Закон Авогадро. Амедео Авогадро (1776 – 1856) В равных объемах различных газов при одинаковых условиях (температура,
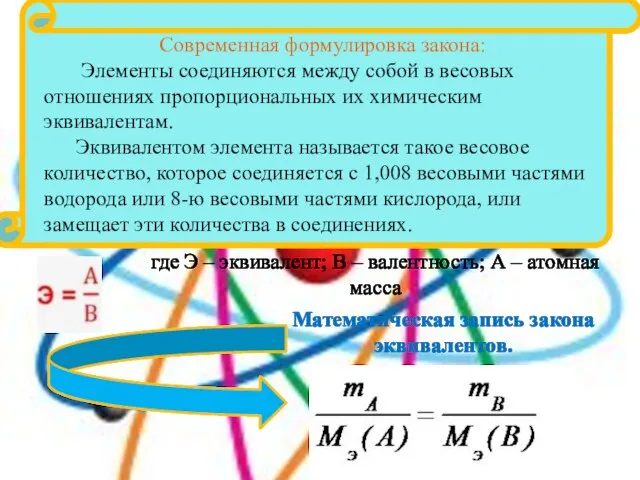
- 12. Закон эквивалентов. Иеремия Вениамин Рихтер (1762 – 1807) «Если одно и то же количество какой-либо кислоты
- 13. где Э – эквивалент; В – валентность; А – атомная масса Математическая запись закона эквивалентов. Современная
- 14. Закон кратных отношений. Джон Дальтон (1766 - 1844) Закон установлен в 1803 году Джоном Дальтоном. Если
- 15. Уравнение Менделеева – Клапейрона. Формула, устанавливающая зависимость между давлением, молярным объемом и абсолютной температурой идеального газа:
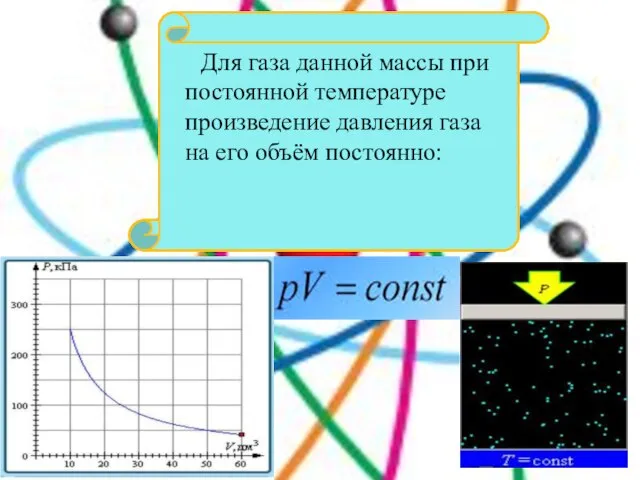
- 16. Закон Бойля – Мариотта. Роберт Бойль (1627 - 1691) В 1660 году открыл закон изменения объёма
- 17. Для газа данной массы при постоянной температуре произведение давления газа на его объём постоянно:
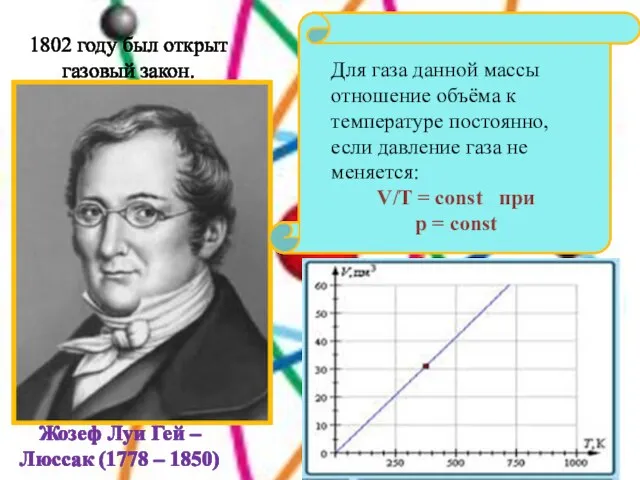
- 18. Для газа данной массы отношение объёма к температуре постоянно, если давление газа не меняется: V/T =
- 19. Задачи для закрепления. Задание № 1. Вычислите число атомов азота в 100г карбоната аммония, содержащего 10%
- 20. http://abouthist.net/wp-content/uploads/2011/09/ris15.png https://encryptedtbn2.gstatic.com/images?q=tbn:ANd9GcQIADrHB7WPhmwtO4xJPC3IcoSq5EUlnTioB7bYfL_Wxg_73M3 http://class-fizika.narod.ru/phys/15.jpg http://lichnosti.net/photos/2682/main.jpg http://img15.nnm.me/3/5/9/c/9/33e15b432c7b16d85194a2064d3.jpg https://encryptedtbn3.gstatic.com/images?q=tbn:ANd9GcSvAL6XFRPQl_il8l6HJixPr5ZvrCatdd4Ulnl7PCj1nlOy3QP http://school-box.ru/images/stories/prezentaziya-po-chimii-zakon-sochraneniya-massi-veshestva.jpg http://www.calend.ru/img/content_events/i0/349.jpg http://images.myshared.ru/199103/slide_9.jpg http://konspekta.net/studopediaorg/baza6/2104455695415.files/image005.png http://image.slidesharecdn.com/reaviz-1-140903150256-phpapp02/95/reaviz-1-19-638.jpg?cb=1409778579 http://www.samara.edu.ru/upload/iblock/4ba/Mendeleev.jpg http://posobie-opt.ru/files/school/175/6.jpg http://bigslide.ru/images/2/1607/960/img8.jpg https://encryptedtbn2.gstatic.com/images?q=tbn:ANd9GcRxVjjP02bKEwpLOCwDS9Z6jnm90MsNRFgRWuN8bvf3TRyEABSR8g
- 22. Скачать презентацию














 Классификация спиртов. Изомерия спиртов
Классификация спиртов. Изомерия спиртов Электрохимия. Электролиты
Электрохимия. Электролиты Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания
Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания Презентация на тему Валентность и степень окисления (8 класс)
Презентация на тему Валентность и степень окисления (8 класс)  Пусть имя Д.И. Менделеева будет нашей путеводной звездой
Пусть имя Д.И. Менделеева будет нашей путеводной звездой Анилин. Строение и свойства анилина
Анилин. Строение и свойства анилина Окислительно=восстановительное титрование
Окислительно=восстановительное титрование Алкины
Алкины Строение и химический состав костей, рост костей
Строение и химический состав костей, рост костей Презентация на тему Серная кислота (9 класс)
Презентация на тему Серная кислота (9 класс)  Электрохимия. Экзаменационные вопросы
Электрохимия. Экзаменационные вопросы Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Современные области применения изотопной продукции
Современные области применения изотопной продукции Прикладная геохимия
Прикладная геохимия Презентация на тему "Азотная кислота"
Презентация на тему "Азотная кислота" Кислоты, соли
Кислоты, соли Ароматические углеводороды. Бензол
Ароматические углеводороды. Бензол Природные источники углеводородов
Природные источники углеводородов Предельные углеводороды. Тест 19
Предельные углеводороды. Тест 19 Нефть
Нефть Судың химиялық потенциялы
Судың химиялық потенциялы Соли
Соли Получение меди
Получение меди Кинетика химических реакций
Кинетика химических реакций Массовая доля выхода продукта реакции от теоретически возможного
Массовая доля выхода продукта реакции от теоретически возможного Типы химических реакций
Типы химических реакций Дисперсные системы. Лекция №7
Дисперсные системы. Лекция №7 Электролитическая диссоциация
Электролитическая диссоциация