Слайд 2Определение
Предельные углеводороды - это органические вещества, состоящие только из углерода и водорода,

соответствующие общей формуле Сn Н2n +2.
У этих веществ только простые одинарные связи между атомами углерода, которые соединяются с максимально возможным количеством числом атомов водорода. Их поэтому называют предельными или насыщенными.
Слайд 3Изомеры
Изомеры - это вещества, имеющие одинаковый качественный и количественный состав, но отличающиеся

по своему строению и свойствам
Изомерия- это явление существования веществ с одинаковым качественным и количественным составом, но отличающимся по своему строению и свойствам
Слайд 4
Примеры изомеров
Для вещества с общей молекулярной формулой С4Н10 существуют 2 изомера:

СН3-СН2-СН2-СН3 (н - бутан, t кип.=-0,50С)
СН3- СН -СН3 (изобутан, t кип.=-11,70С)
|
СН3
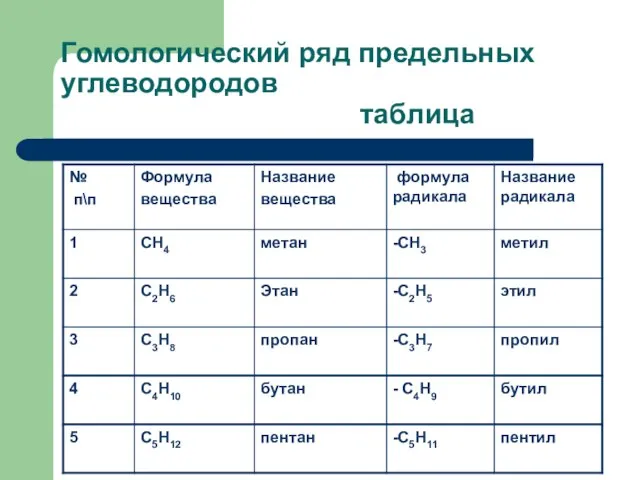
Слайд 5Гомологический ряд предельных углеводородов
таблица
Слайд 7Гомологи
Гомологи – вещества, расположенные в порядке возрастания относительных молекулярных масс, сходных по

строению и свойствам, но отличающихся друг от друга по составу на одну или несколько групп -СН2-
Гомологический ряд- ряд веществ, расположенных в порядке возрастания относительных молекулярных масс, сходных по строению и свойствам, но отличающихся друг от друга по составу на одну или несколько групп -СН2-
Слайд 8Физические свойства предельных углеводородов
Агрегатное состояние: первые четыре члена гомологического ряда(С1-С4) – газы,

С5-С15- жидкости, С16 и более тяжелые – твердые вещества
Температура кипения и плавления постепенно увеличиваются с ростом молекулярной массы вещества
Растворимость в воде - плохая
Слайд 9Нахождение в природе и получение предельных углеводородов
Предельные углеводороды встречаются:
√ в природном

газе (98%- метан);
√ в попутном нефтяном газе (С1-С6);;
√ в нефти (С5-С50);
√ в каменном угле
Получают их из природного сырья.
Слайд 10Химические свойства предельных углеводородов
Для предельных углеводородов характерны следующие химические реакции:
√ замещения (по

свободно-радикальному механизму);
√ окисления (полное и неполное);
√ разложения (крекинг, дегидрирование);
√ изомеризации.
Для предельных углеводородов совсем не характерны реакции присоединения.
Слайд 11Реакции замещения
1. Реакция хлорирования на свету
1 2 3 4
СН4 →СН3 Сl →СН2

Сl 2 →СН Сl 3 →С Сl 4
СН4 +Cl2 → СН3 Сl (первая стадия)
хлорметан
2. СН3 Сl +Cl2 → СН2 Сl 2 (вторая стадия)
дихлорметан
3. СН2 Сl 2 +Cl2 → СН Сl 3 (третья стадия)
тр ихлорметан
4. СН Сl 3 +Cl2 → С Сl 4 (четвертая стадия)
тетрахлорметан
2. Реакция нитрования(реакция Коновалрва)
СН4 +НNO3→ СН3 NO2 +H2O
Слайд 12Реакции окисления
Полное окисление – горение
СН4 + 2О 2→СО 2 +2Н2О +Q
2. Неполное

окисление
СН4 + [О] →метиловый спирт, м метаналь (формальдегид),
метановая (муравьиная)кислота
Слайд 13Реакции разложения
1. крекинг (реакции идут при нагревании с разрывом углеродной цепи)
15000С
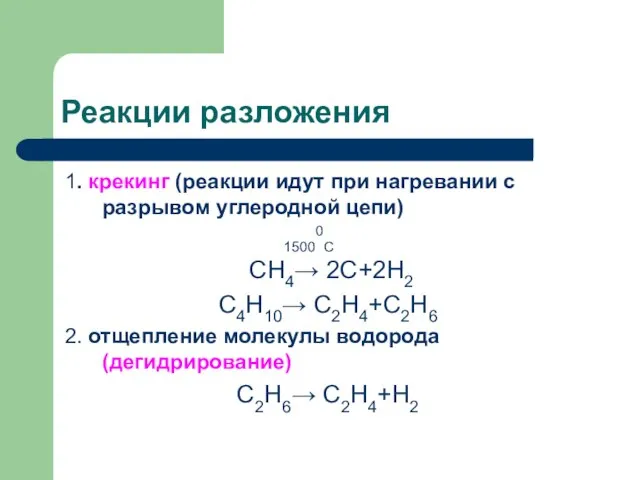
СН4→ 2С+2Н2
С4Н10→ С2Н4+С2Н6
2. отщепление молекулы водорода (дегидрирование)
С2Н6→ С2Н4+Н2
Слайд 14Реакции изомеризации
В реакциях изомеризации не меняется количественный и качественный состав веществ, меняется
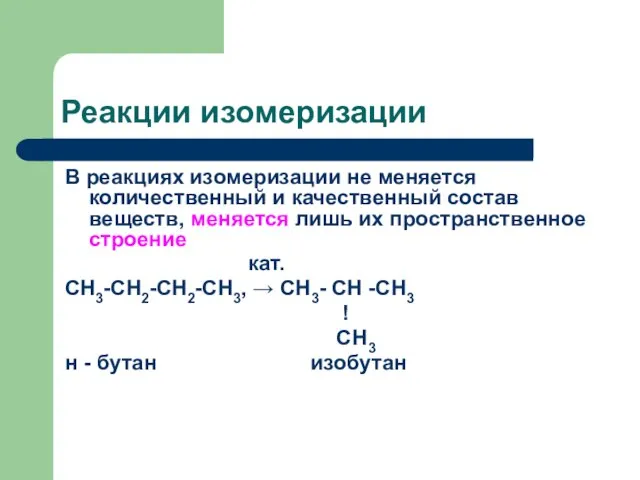
лишь их пространственное строение
кат.
СН3-СН2-СН2-СН3, → СН3- СН -СН3
!
СН3
н - бутан изобутан












 Хлор и хлороводород
Хлор и хлороводород Новейшие достижения в области высокомолекулярных соединений
Новейшие достижения в области высокомолекулярных соединений α-Аминокислоты
α-Аминокислоты Различные варианты заданий ЕГЭ по теме Электролиз
Различные варианты заданий ЕГЭ по теме Электролиз 676a1c5e85f2455c9a6d495b8a94b9f9
676a1c5e85f2455c9a6d495b8a94b9f9 Презентация на тему Моющие и чистящие средства
Презентация на тему Моющие и чистящие средства  Из опыта использования интерактивной доски на уроках химии
Из опыта использования интерактивной доски на уроках химии Интеллектуальные игры. Химия
Интеллектуальные игры. Химия Химические уравнения
Химические уравнения 42. Ионные уравнения
42. Ионные уравнения Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс
Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс علاوي الندوة
علاوي الندوة Силикаты
Силикаты Действие фермента каталазы на пероксид водорода
Действие фермента каталазы на пероксид водорода Предмет органической химии. Урок №1
Предмет органической химии. Урок №1 Презентация на тему Дисахариды
Презентация на тему Дисахариды  Теория электролитической диссоциации
Теория электролитической диссоциации Алкины
Алкины Флотационный способ обогащения
Флотационный способ обогащения Обобщение по теме Теория химического строения органических веществ
Обобщение по теме Теория химического строения органических веществ Минералы алюминия
Минералы алюминия Доказательство амфотерности аминокислот. Продукты, содержащие аминокислоты и их соли
Доказательство амфотерности аминокислот. Продукты, содержащие аминокислоты и их соли Биологическое значение брома и йода
Биологическое значение брома и йода Задачи. Химические элементы
Задачи. Химические элементы Интеллектуальная игра по химии, биологии, географии. Роль химических соединений. 10 класс
Интеллектуальная игра по химии, биологии, географии. Роль химических соединений. 10 класс Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Аналитические методы в современных исследованиях химии
Аналитические методы в современных исследованиях химии Общая характеристика галогенов
Общая характеристика галогенов