Содержание
- 2. ЦЕЛЬ УРОКА: Установление взаимосвязи между состоянием равновесия системы и способах его регулирования ЗАДАЧИ УРОКА: 1. Рассмотреть
- 3. СОСТОЯНИЕ РАВНОВЕСИЯ В ПРИРОДЕ Постоянство внутренней среды организма: АССИМИЛЯЦИЯ ДИССИМИЛЯЦИЯ Постоянство численности особей в популяции: ЕСТЕСТВЕННЫЙ
- 4. Под … равновесием мы понимаем состояние, в котором свойства системы, определенные экспериментально, не претерпевают дальнейшего изменения
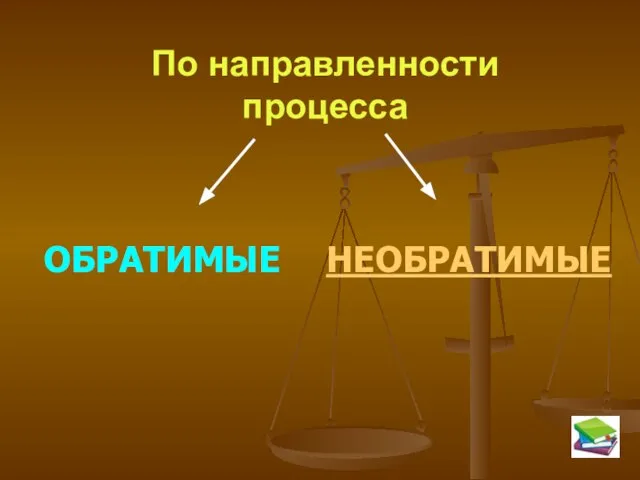
- 5. По направленности процесса ОБРАТИМЫЕ НЕОБРАТИМЫЕ
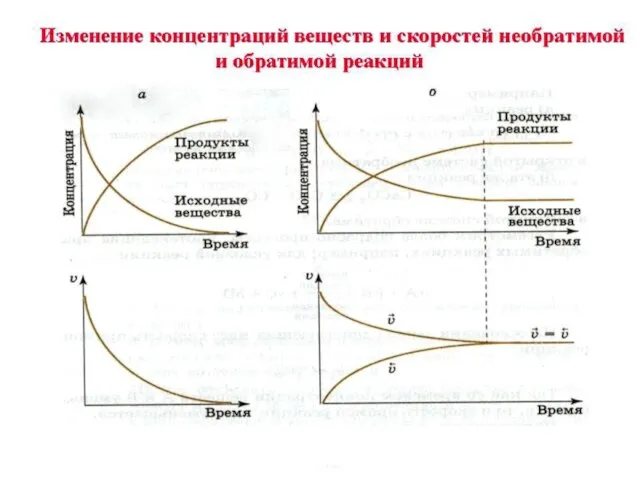
- 6. Обратимые реакции – это реакции, протекающие в данных условиях одновременно в двух противоположных направлениях Таких реакций
- 7. НЕОБРАТИМЫЕ РЕАКЦИИ – ЭТО РЕАКЦИИ, ПРОТЕКАЮЩИЕ В ДАННЫХ УСЛОВИЯХ ТОЛЬКО В ОДНОМ НАПРАВЛЕНИИ. К ним можно
- 8. N 2 + 3 H2 2 NH3 прямая обратная Состояние системы, при котором скорость прямой реакции
- 10. ПРИНЦИП ЛЕ ШАТЕЛЬЕ Если на систему, находящуюся в состоянии равновесия произвести внешнее воздействие (изменить давление, температуру,
- 11. Анри Луи Ле Шателье (8. 10. 1850 – 17. 09. 1936) Французский физикохимик и металловед, член
- 12. 1. Концентрация N2 + 3 H2 Реагирующие вещества Продукты реакции СРЕАГИРУЮЩИХ ВЕЩЕСТВ ВПРАВО СПРОДУКТОВ РЕАКЦИИ ВЛЕВО
- 13. 2. Температура эндотермическая реакция ( - Q ) экзотермическая реакция ( + Q ) N2 +
- 14. Экзотермические реакции – это реакции, протекающие с выделением теплоты. К ним обычно относятся все реакции соединения.
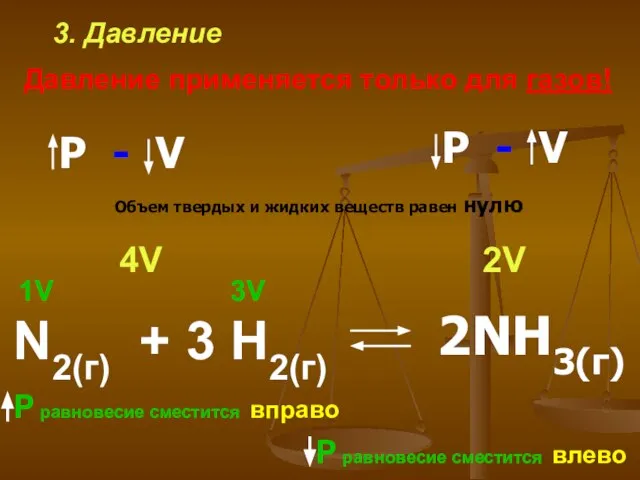
- 16. 3. Давление Давление применяется только для газов! N2(г) + 3 H2(г) 1V 3V 2V 4V Р
- 17. В какую сторону сместится равновесие в обратимом процессе, уравнение которого 2 NO(г) + O2(г) ⬄ 2
- 18. Как известно, в воздухе содержится 21% кислорода (по массе). Такое количество необходимо для поддержания естественного равновесия:
- 19. Домашнее задание: Принцип Ле Шателье широко используется в химической технологии для повышения выхода продукта производства. Согласуется
- 21. Скачать презентацию















 Путешествие по городу химиков
Путешествие по городу химиков Bioenergetyka syntezy glutaminy
Bioenergetyka syntezy glutaminy Химики на службе у дорог
Химики на службе у дорог Кислоты
Кислоты Презентация на тему Жиры, их строение и свойства
Презентация на тему Жиры, их строение и свойства  Тест: Азот
Тест: Азот Положение галогенов в Периодической системе Д.И. Менделеева
Положение галогенов в Периодической системе Д.И. Менделеева Осмотическое давление
Осмотическое давление Алюминий
Алюминий Фуллерены: аллотропы углерода
Фуллерены: аллотропы углерода Карбонаты. Лекция 12
Карбонаты. Лекция 12 Основные понятия органической химии
Основные понятия органической химии Теория валентных связей
Теория валентных связей Химия в быту
Химия в быту _Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1)
_Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1) Презентация на тему Что такое нано?
Презентация на тему Что такое нано?  Химические свойства и получение насыщенных одноатомных спиртов
Химические свойства и получение насыщенных одноатомных спиртов Сера и её соединения
Сера и её соединения Оксиды и гидроксиды металлов
Оксиды и гидроксиды металлов Презентация на тему Типы химических реакций (8 класс)
Презентация на тему Типы химических реакций (8 класс)  Лаборатория молекулярной спектроскопии и анализа
Лаборатория молекулярной спектроскопии и анализа Окислительновосстановительные реакции в z природе и жизни человека
Окислительновосстановительные реакции в z природе и жизни человека ОГЭ №2, вопрос 1-16
ОГЭ №2, вопрос 1-16 Общая характеристика криптона
Общая характеристика криптона Органическая химия. Йенс Якоб Берцелиус (1779 - 1848)
Органическая химия. Йенс Якоб Берцелиус (1779 - 1848) Презентация на тему Основные химические понятия
Презентация на тему Основные химические понятия  Классификация минералов + самородные элементы. Занятие 5
Классификация минералов + самородные элементы. Занятие 5 Химические свойства амфотерных оксидов и гидроксидов
Химические свойства амфотерных оксидов и гидроксидов