лекарств и пищевых продуктов. Рубидий и его сплавы с цезием — это весьма перспективный теплоноситель и рабочая среда для высокотемпературных турбоагрегатов (в этой связи рубидий и цезий в последние годы приобрели важное значение, и чрезвычайная дороговизна металлов уходит на второй план по отношению к возможностям резко увеличить КПД турбоагрегатов, а значит, и снизить расходы топлива и загрязнение окружающей среды). Применяемые наиболее широко в качестве теплоносителей системы на основе рубидия — это тройные сплавы: натрий-калий-рубидий, и натрий-рубидий-цезий.
В катализе рубидий используется как в органическом, так и неорганическом синтезе. Каталитическая активность рубидия используется в основном для переработки нефти на ряд важных продуктов. Ацетат рубидия, например, используется для синтеза метанола и целого ряда высших спиртов из водяного газа, что актуально в связи с подземной газификацией угля и в производстве искусственного жидкого топлива для автомобилей и реактивного топлива. Ряд сплавов рубидия с теллуром обладают более высокой чувствительностью в ультрафиолетовой области спектра, чем соединения цезия, и в связи с этим он способен в этом случае составить конкуренцию цезию как материал для фотопреобразователей.









 Осуществление цепочки химических превращений. Практическая работа №1
Осуществление цепочки химических превращений. Практическая работа №1 Основы химической термодинамики и термохимии. Лекция 5
Основы химической термодинамики и термохимии. Лекция 5 Презентация по Химии "Химическая номенклатура и филология"
Презентация по Химии "Химическая номенклатура и филология"  Круговорот серы в природе
Круговорот серы в природе Классификация неорганических веществ
Классификация неорганических веществ Железо и его соединения
Железо и его соединения Дизайн молекулярных магнетиков
Дизайн молекулярных магнетиков Открытый урок химии. Типы химических реакций
Открытый урок химии. Типы химических реакций Практическая работа №5. Качественные реакции на анионы 1-3 групп
Практическая работа №5. Качественные реакции на анионы 1-3 групп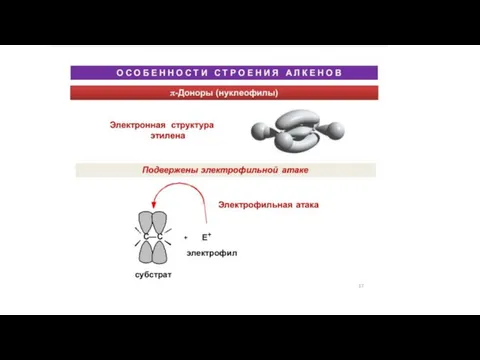 Особенности строения алкенов
Особенности строения алкенов Белки. Структуры белков
Белки. Структуры белков Химические реакции в органической химии
Химические реакции в органической химии План для домашней работы по теме Алкадиены
План для домашней работы по теме Алкадиены Презентация на тему Каучуки
Презентация на тему Каучуки  Степень окисления
Степень окисления Строение вещества
Строение вещества Оксиды неметаллов и металлов. Состав и названия
Оксиды неметаллов и металлов. Состав и названия 01. Химический состав
01. Химический состав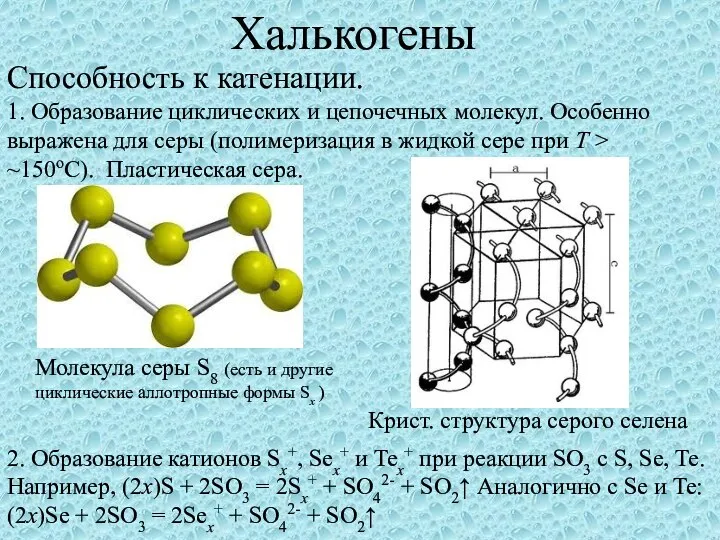 Халькогены. Способность к катенации
Халькогены. Способность к катенации Виды оксидов азота
Виды оксидов азота Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік
Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік Кристаллические решетки, вид связи и свойства веществ
Кристаллические решетки, вид связи и свойства веществ Электронная конфигурация атома
Электронная конфигурация атома Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Оксиды. Физические свойства
Оксиды. Физические свойства Графит. 9 класс
Графит. 9 класс Кислоты
Кислоты