Содержание
- 2. Кислород — химический элемент 16-й группы, второго периода периодической системы, с атомным номером 8. Относится к
- 3. Характеристика кислорода по таблице Менделеева
- 4. Строение электронной оболочки кислорода На внешнем электронном уровне – 6 электронов. Строение электронной оболочки атома кислорода:
- 5. Возможные степени окисления Кислород в соединениях имеет постоянную степень окисления, равную -2 (H2+1O-2, Fe+2O-2, Mn2+7O7-2). Исключение
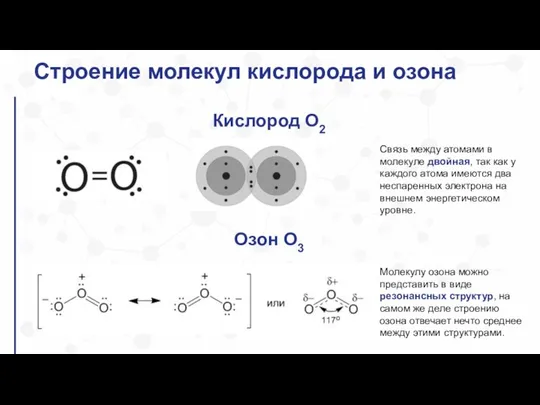
- 6. Строение молекул кислорода и озона Кислород O2 Озон О3 Молекулу озона можно представить в виде резонансных
- 7. Сравнение физических свойств озона и кислорода
- 8. Кислород – нахождение в природе Кислород – самый распространённый элемент на Земле. На его долю в
- 9. Задание №1 Определите, какое количество (массовая концентрация) связанного кислорода содержится в морских и пресных водах? Ответ
- 10. Озон в стратосфере
- 11. Озон в стратосфере Озон поглощает 97% ультрафиолетовой солнечной радиации, губительно действующей на живые организмы, тем самым
- 12. Озон в тропосфере Те самые молекулы озона, которые защищают нас от губительного действия ультрафиолетового излучения, в
- 13. Взаимные превращения кислорода и озона В тропосфере озон образуется во время грозы: 3О2 = 2О3 (эл.
- 14. Химические свойства кислорода Кислород обладает высокой химической активностью, он окисляет многие вещества уже при комнатной температуре.
- 15. Химические свойства кислорода При взаимодействии кислорода со многими веществами выделяются теплота и свет. Эти процессы называются
- 16. Химические свойства кислорода При комнатной температуре кислород реагирует с щелочными и щелочно-земельными металлами. Литий и кальций
- 17. Химические свойства кислорода При нагревании кислород реагирует практически со всеми металлами, образуя оксиды: 4Al + 3O2
- 18. Химические свойства кислорода Кислород взаимодействует практически со всеми простыми веществами-неметаллами, кроме хлора, брома, иода и инертных
- 19. Химические свойства кислорода С водородом кислород образует взрывоопасную смесь. При объёмном соотношении H2 : O2 =
- 20. Химические свойства кислорода Кислород взаимодействует со многими сложными веществами. Например, реакции обжига сульфидов металлов: CuS +
- 21. Химические свойства кислорода Кислород взаимодействует со многими сложными веществами. Например, реакции обжига сульфидов металлов: 2CuS +
- 22. Химические свойства кислорода При сгорании органических веществ в избытке кислорода образуются вода и углекислый газ, например,
- 23. Получение кислорода в лаборатории
- 24. Получение кислорода в промышленности Сжижением воздуха с помощью холодильных машин. Далее, используя различие температур кипения кислорода
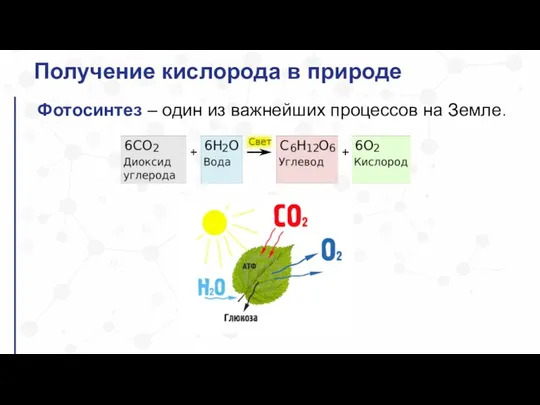
- 25. Получение кислорода в природе Фотосинтез – один из важнейших процессов на Земле.
- 26. Применение кислорода В сельском хозяйстве; В тепловой энергетике и металлургии; В нефтедобыче; В медицине; В военной
- 27. Применение озона Дезинфекция воды; Отбеливание тканей и некоторых материалов; В медицине; Для идентификации соединений.
- 28. Почему небо голубое? Причина – рассеяние Рэлея. Когда свет движется через атмосферу, большая часть длинных волн
- 30. Скачать презентацию

























 Чистые вещества и смеси. Классификация веществ. Оксиды
Чистые вещества и смеси. Классификация веществ. Оксиды История развития органической химии
История развития органической химии Радиоакивные металлы
Радиоакивные металлы Химические свойства кислот
Химические свойства кислот Диаграмма состояния BaO-Al2O3-SiO2
Диаграмма состояния BaO-Al2O3-SiO2 Простые эфиры и перекиси
Простые эфиры и перекиси Химическое ассорти
Химическое ассорти Якісні реакції органічних речовин
Якісні реакції органічних речовин Цветные опыты
Цветные опыты Фарфор и фаянс
Фарфор и фаянс Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10
Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10 Химическое равновесие. Экзаменационные вопросы
Химическое равновесие. Экзаменационные вопросы Опасность вещества поливинилхлорида
Опасность вещества поливинилхлорида ИКТ как средство реализации проблемного обучения на уроках химии
ИКТ как средство реализации проблемного обучения на уроках химии ЦОКО 2 курс. Химия
ЦОКО 2 курс. Химия Липиды. Состав липидов
Липиды. Состав липидов Никель
Никель Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс
Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс Химические свойства оксидов
Химические свойства оксидов Природный газ, состав применение в качестве топлива
Природный газ, состав применение в качестве топлива Типы химических реакций. Что такое химическая реакция?
Типы химических реакций. Что такое химическая реакция? Углеводороды: изомерия
Углеводороды: изомерия Генетические ряды неорганических веществ
Генетические ряды неорганических веществ Разбор задач
Разбор задач Периодическая система
Периодическая система Оксиды и их свойства
Оксиды и их свойства Презентация на тему Простые вещества - неметаллы
Презентация на тему Простые вещества - неметаллы  Обмен жиров в организме млекопитающего
Обмен жиров в организме млекопитающего