Содержание
- 2. Происхождение названий щелочных металлов Li (1817) лат. " литос" - камень Na (1807) араб. "натрум" -сода
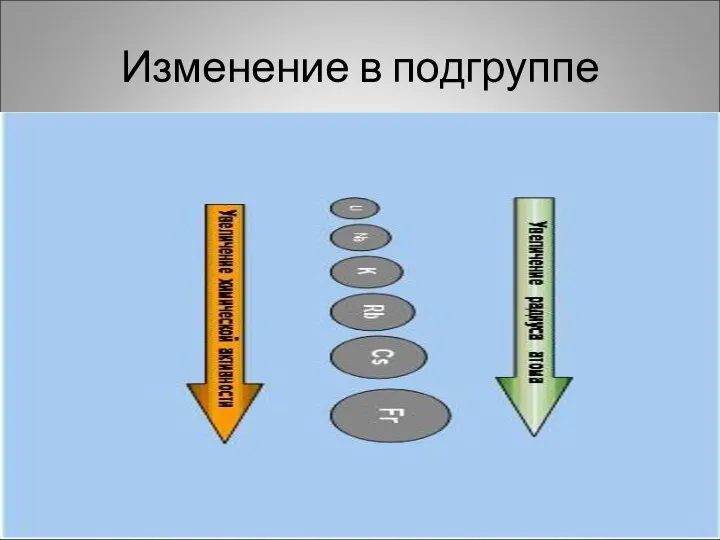
- 3. Положение в периодической системе химических элементов Д.И.Менделеева I группа главная подгруппа. Увеличивается радиус атомов , растет
- 4. Изменение в подгруппе
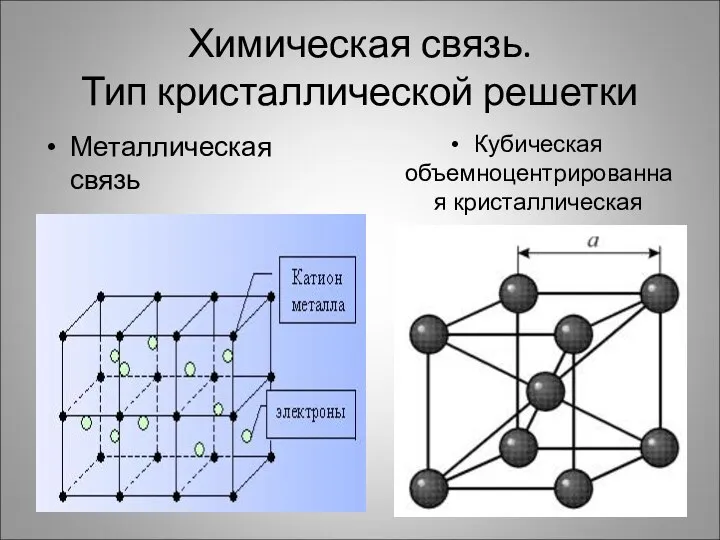
- 6. Химическая связь. Тип кристаллической решетки Металлическая связь Кубическая объемноцентрированная кристаллическая решетка
- 9. Щелочные металлы – простые вещества Литий Натрий Литий и натрий - мягкие щелочные металлы серебристо-белого цвета
- 10. Щелочные металлы Калий Рубидий Калий и рубидий мягкие щелочные металлы серебристо-белого цвета
- 11. Щелочные металлы цезий Цезий 99,99999% в ампуле Мягкий щелочной металл золотисто-белого цвета
- 12. Франций Франций - щелочной металл, обладающий как радиоактивностью, так и высокой химической активностью . Не имеет
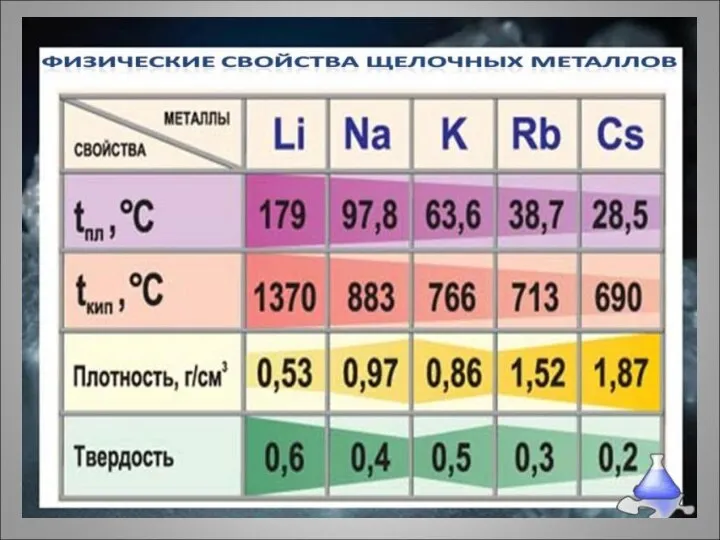
- 13. Химические свойства щелочных металлов Типичные металлы, очень сильные восстановители. В соединениях проявляют единственную степень окисления +1.
- 14. Химические свойства 2Na + Cl2 = 2NaCl (в атмосфере F2 и Cl2 щелочные Me самовоспламеняются) 4Li
- 15. Качественное определение щелочных металлов Li+ Na+ K+ Для распознавания соединений щелочных металлов по окраске пламени исследуемое
- 16. Получение щелочных металлов 1) Электролиз расплавов соединений щелочных металлов: 2МеCl = 2Ме + Cl2 4МеOH =
- 17. Применение щелочных металлов БИОЛОГИЧЕСКАЯ РОЛЬ И ПРИМЕНЕНИЕ СОЕДИНЕНИЙ КАЛИЯ И НАТРИЯ
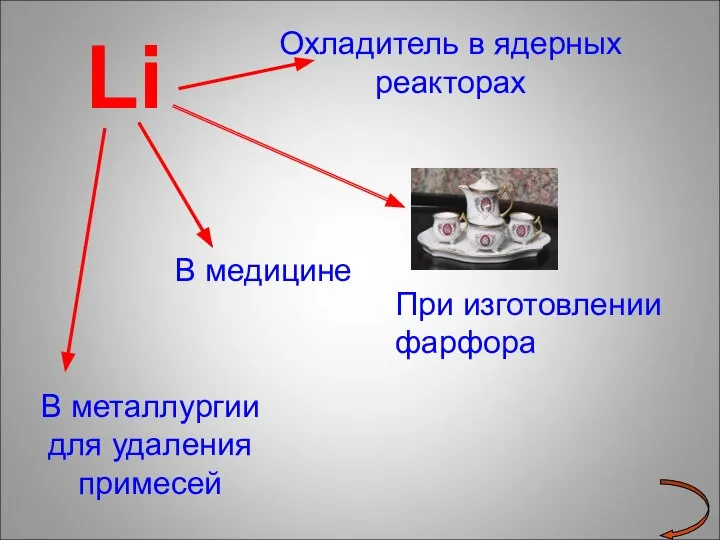
- 18. Li Охладитель в ядерных реакторах В медицине В металлургии для удаления примесей При изготовлении фарфора
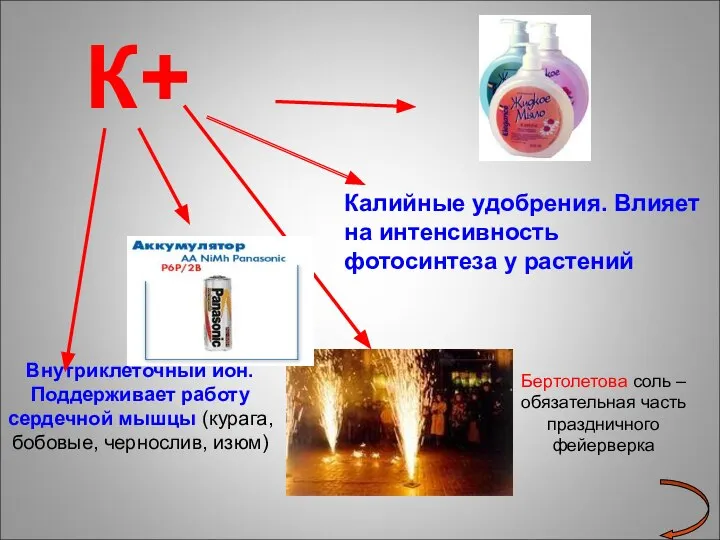
- 19. К+ Внутриклеточный ион. Поддерживает работу сердечной мышцы (курага, бобовые, чернослив, изюм) Калийные удобрения. Влияет на интенсивность
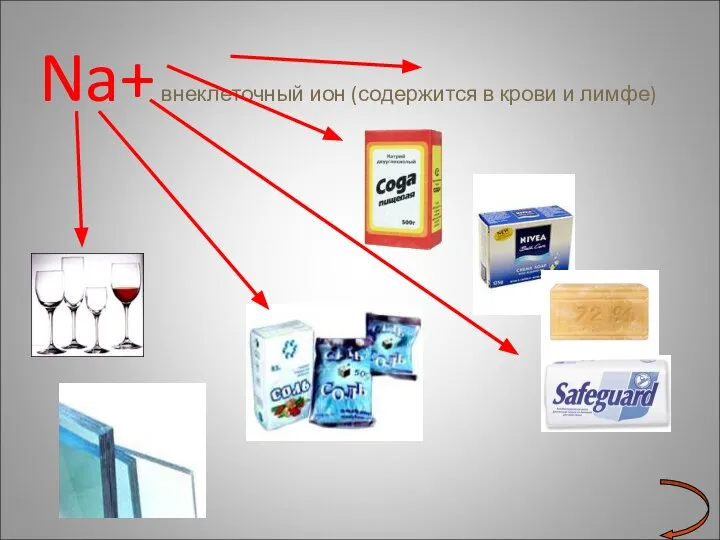
- 20. Na+ внеклеточный ион (содержится в крови и лимфе)
- 21. Сподуменн
- 22. Галит
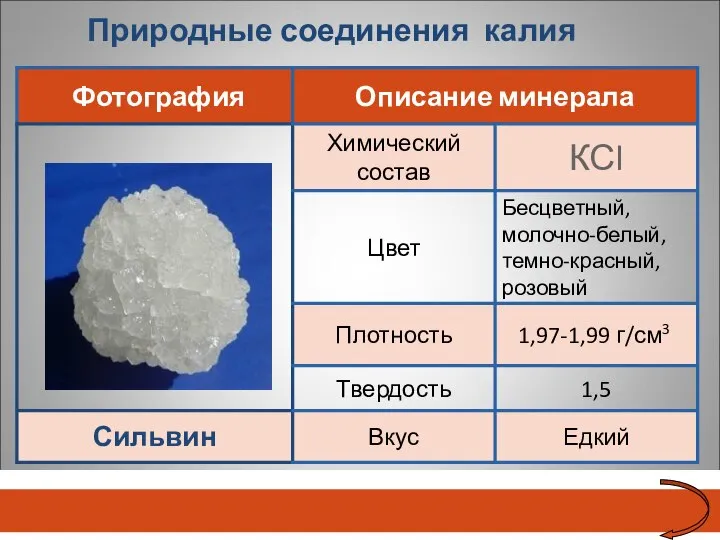
- 23. Природные соединения калия Сильвин
- 25. Скачать презентацию















 Типы кристаллических решеток
Типы кристаллических решеток Разбор ДЗ. Титрование – общие моменты
Разбор ДЗ. Титрование – общие моменты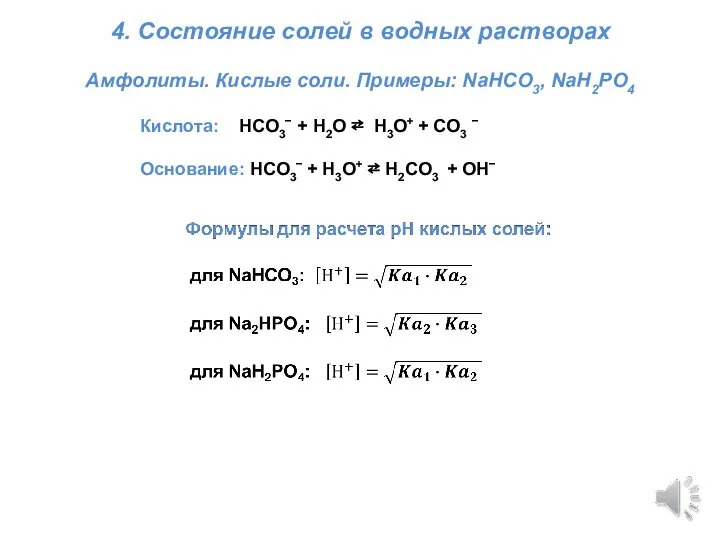 Титриметрия. Состояние солей в водных растворах
Титриметрия. Состояние солей в водных растворах Трансляция. Активизирование аминокислоты
Трансляция. Активизирование аминокислоты СТЕПЕНЬ ОКИСЛЕНИЯ
СТЕПЕНЬ ОКИСЛЕНИЯ Общая химическая технология. Определение размеров реакторов. Практическое занятие 8
Общая химическая технология. Определение размеров реакторов. Практическое занятие 8 Строение атома. Экзаменационные вопросы
Строение атома. Экзаменационные вопросы Незаменимая уксусная кислота
Незаменимая уксусная кислота Подготовка выпускников к ГИА по химии: опыт, проблемы, перспективы
Подготовка выпускников к ГИА по химии: опыт, проблемы, перспективы Виды изомерии. Углеводороды
Виды изомерии. Углеводороды 10В Циклоалканы (1)
10В Циклоалканы (1) Коррозия металлов. Способы защиты от коррозии
Коррозия металлов. Способы защиты от коррозии Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Жиры. Открытие жиров
Жиры. Открытие жиров Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева Основные классы неорганических соединений. Лекция №3
Основные классы неорганических соединений. Лекция №3 Вязкость жидкости
Вязкость жидкости Циклоалканы (полиметиленовые, циклопарафины, ациклические)
Циклоалканы (полиметиленовые, циклопарафины, ациклические) Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс
Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс Алкины, гомологический ряд алкинов. Электронное и пространственное строение алкинов на примере ацетилена (1)
Алкины, гомологический ряд алкинов. Электронное и пространственное строение алкинов на примере ацетилена (1) Вычисление массовой доли элемента в молекуле
Вычисление массовой доли элемента в молекуле Физико-химические процессы в гидросфере
Физико-химические процессы в гидросфере Химия в быту
Химия в быту Фосфор, строение, свойства
Фосфор, строение, свойства Классификация органических соединений
Классификация органических соединений Химия и производство
Химия и производство Металлы и их соединения. Решение экспериментальных задач
Металлы и их соединения. Решение экспериментальных задач Диффузия в металлах и сплавах
Диффузия в металлах и сплавах