Содержание
- 2. Яхта «Зов моря»
- 3. Колосс Родосский
- 4. Рухнувший мост в Квебеке
- 5. Антенная мачта
- 6. Коррозия металлов. Способы защиты от коррозии.
- 7. Цель урока: Сформировать представление о коррозии металлов как самопроизвольном окислительно-восстановительном процессе, ее значении, причинах, механизме и
- 8. ЗНАТЬ – ЗНАЧИТ ПОБЕДИТЬ! А.Н. Несмеянов
- 9. Коррозия – от лат. corrodere - разъедать
- 12. Коррозия – это процесс самопроизвольного разрушения материалов и изделий из них под химическим воздействием окружающей среды.
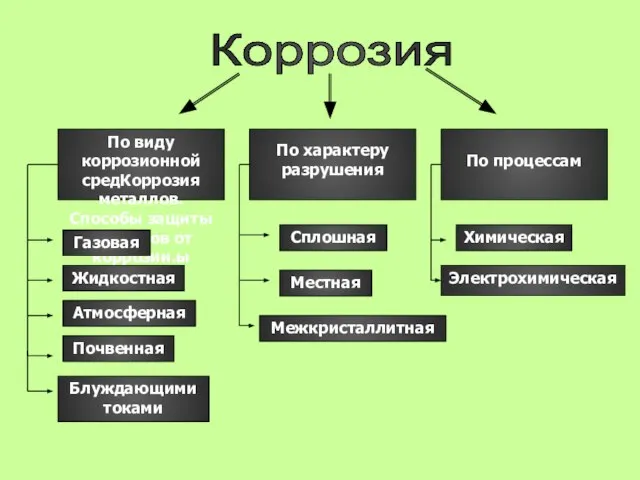
- 13. Коррозия По виду коррозионной средКоррозия металлов. Способы защиты металлов от коррозии.ы По характеру разрушения По процессам
- 14. По виду коррозионной среды По виду коррозионной среды Газовая Атмосферная Жидкосная Почвенная Блуждающие тока
- 15. По характеру разрушений
- 16. Сплошная коррозия Равномерная Неравномерная
- 17. Местная коррозия Язвенная Точечная Пятнами
- 18. Химическая коррозия Химическая коррозия – самопроизвольное разрушение металлов в среде окислительного газа (кислорода, галогенов и т.д.)
- 19. Электрохимическая коррозия Электрохимическая коррозия – самопроизвольный процесс разрушения металлов в среде электролитов или при контакте с
- 20. Ущерб, наносимый коррозией Мировая потеря 20 млн. тонн металла в год Еще более значимы косвенные потери
- 22. 1 стакан: Fe + H2O 2 стакан: Fe + р-р NaCl 3 стакан: Fe, Cu +
- 23. Защита металлов от коррозии «Просто знать – ещё не всё, знания нужно уметь использовать» Гёте
- 24. Нанесение защитных покрытий Пластмасса Краска Лак Грунтовка Смола Эмаль Масло
- 25. Покрытие антикоррозионным металлом Хромирование Никелирование Оцинковка
- 26. Позолота Покрытие антикоррозионным металлом Лужение Покрытие алюминием
- 27. Нержавеющие стали Cr Co Ni Cu
- 28. Применение ингибиторов Ингибиторы - это вещества, способные замедлять протекание химических процессов или останавливать их. Известно более
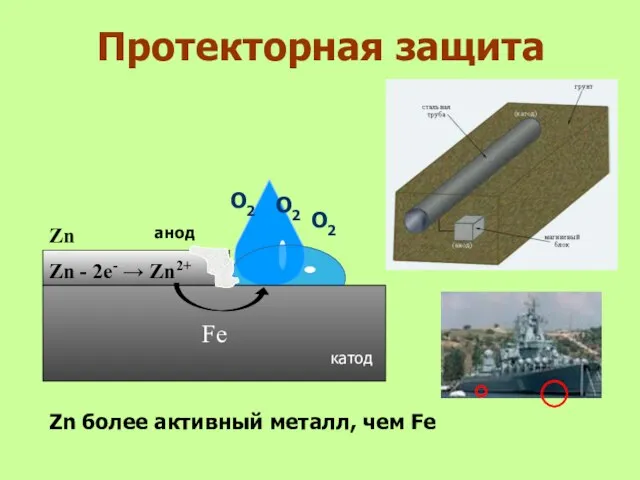
- 29. Протекторная защита анод Fe О2 О2 Zn - 2е- → Zn2+ катод Zn более активный металл,
- 30. Делийская железная колонна Высота 7, 2 м, вес около 6,5 тонн Возраст 1600 лет
- 31. Тренировочный тест 1. Слово “коррозия” в переводе с латинского означает: а) разрушать; б) разъедать; в) ржаветь.
- 32. 4. Разрушение металла, находящегося в контакте с другим металлом в присутствии водного раствора электролита: а) газовая
- 33. 7. Вещества, замедляющие процесс коррозии называются: а) протекторы; б) электроды; в) ингибиторы. 8. Присоединение к защищаемому
- 34. 10. По характеру разрушений выделяют: а) повсеместную коррозию; б) сплошную; в) разрозненную. 11. Некоторые металлы не
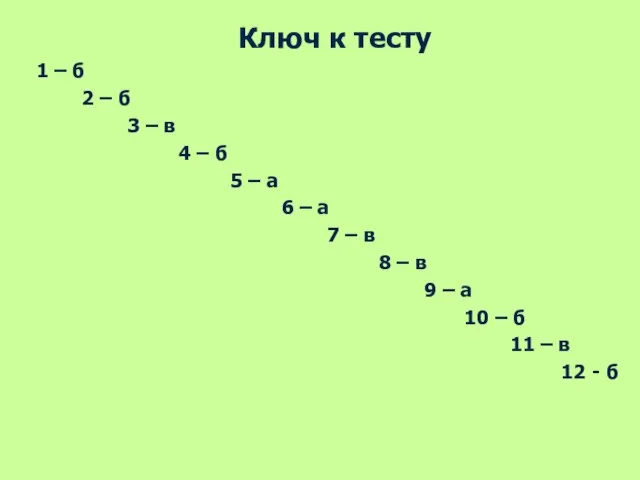
- 35. Ключ к тесту 1 – б 2 – б 3 – в 4 – б 5
- 37. Скачать презентацию































 Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12
Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12 Степени окисления химических элементов в соединениях
Степени окисления химических элементов в соединениях Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Строение , свойства и биологическая роль гликолипидов. Тема 14
Строение , свойства и биологическая роль гликолипидов. Тема 14 Алканы. Физические свойствава алканов
Алканы. Физические свойствава алканов Химия как наука. Краткая история развития химии. Значение химии
Химия как наука. Краткая история развития химии. Значение химии Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость
Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость Полимеры и пластмассы
Полимеры и пластмассы Блок колонн на установке замедленного коксования производительностью 730000 тонн/год гудрона (поз.к-1, кх-1)
Блок колонн на установке замедленного коксования производительностью 730000 тонн/год гудрона (поз.к-1, кх-1) Ионная связь
Ионная связь Метаболизм липидов
Метаболизм липидов Адамсит. Дигидрофенарсазинхлорид HN(C6H4)2AsCl
Адамсит. Дигидрофенарсазинхлорид HN(C6H4)2AsCl Задача 11 Ртутное сердце Команда: Мастера Беспорядка
Задача 11 Ртутное сердце Команда: Мастера Беспорядка Окислительно=восстановительное титрование
Окислительно=восстановительное титрование Альдегиды. Строение молекул
Альдегиды. Строение молекул Алгебраический метод решения задач В-9 – элемент решения задач С4
Алгебраический метод решения задач В-9 – элемент решения задач С4 Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов
Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов Презентация на тему Хлор
Презентация на тему Хлор  Классификация коррозионных процессов металлов
Классификация коррозионных процессов металлов Классификация и номенклатура ОС
Классификация и номенклатура ОС Путешествие в мир кислот
Путешествие в мир кислот Строение и химические свойства галогенов
Строение и химические свойства галогенов Знакомый и незнакомый углерод (9 класс)
Знакомый и незнакомый углерод (9 класс) Термореактивные пластмассы (реактопласты)
Термореактивные пластмассы (реактопласты) Реакции разложения
Реакции разложения Определение степеней окисления и расстановка коэффициентов в ОВР
Определение степеней окисления и расстановка коэффициентов в ОВР Понятие о предельных углеводородах. Алканы
Понятие о предельных углеводородах. Алканы