Содержание
- 2. Электрохимия - наука, изучающая химические процессы, вследствие которых в системе возникает электрический ток Процессы, протекающие на
- 3. Движение ионов в электрическом поле. Числа переноса. Без электрического поля ионы в электролите движутся хаотически. При
- 4. Потенциал двойного электрического слоя, образующегося на границе между металлом и раствором его соли, носит название электродного
- 5. Гальванический элемент. Элемент Даниэля- Якоби Гальваническим элементом называется любое устройство, в котором энергия химической реакции непосредственно
- 6. Гальванический элемент Даниэля-Якоби состоит из медной пластинки, погруженной в раствор СuSO4 и цинковой пластинки, погруженной в
- 7. Уравнение Нернста Потенциал Е электрода рассчитывают по формуле Нернста: где аOx и aRed – активности окисленной
- 8. Окислительно-восстановительные гальванические элементы Особенностью данных элементов является то, что 1) металл электрода (обычно платина) не принимает
- 9. Классификация электродов Условно все известные электроды можно разделить на 3 основные группы: металлические, электроды сравнения и
- 10. Электроды сравнения Электроды сравнения — электрохимические системы, предназначенные для измерения электродных потенциалов. Электроды сравнения обладают постоянным
- 11. Хлорсеребряный электрод представляет собой серебряную пластинку, покрытую слоем хлорида серебра и погруженную в раствор содержащий ионы
- 12. Индикаторные электроды Индикаторные электроды - электроды, используемые в сочетании с электродами сравнения, называют индикаторными или электродами
- 13. Хингидронный электрод Электрод представляет собой платиновую проволоку, опущенную в насыщенный раствор хингидронаС6Н4О2·С6Н4(ОН)2 Потенциалообразующей является следующая реакция:
- 14. Стеклянный электрод Представляет собой стеклянный шарик, изготовленный из стекла, содержащего большое количество щелочных металлов – лития
- 16. Скачать презентацию













 Моноенаминирование 4-пиронов и 4-метилен-4н-пиранов
Моноенаминирование 4-пиронов и 4-метилен-4н-пиранов Основные особенности процессов растворения твёрдых веществ
Основные особенности процессов растворения твёрдых веществ Ароматические вещества и их значение для человека
Ароматические вещества и их значение для человека Практика по химии
Практика по химии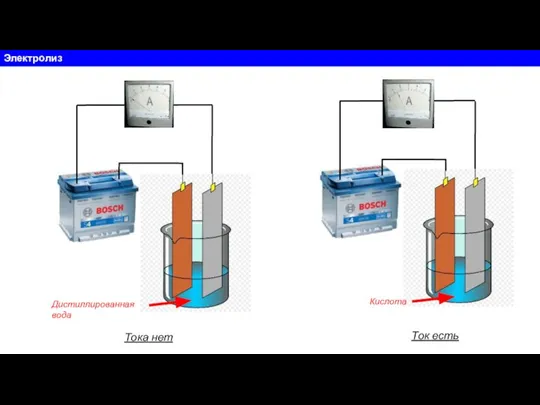 Электролиз. Электролитическая диссоциация
Электролиз. Электролитическая диссоциация Степени окисления химических элементов в соединениях
Степени окисления химических элементов в соединениях Уравнения диссоциации
Уравнения диссоциации Основные сведения о строении атома. Состав атомных ядер
Основные сведения о строении атома. Состав атомных ядер Валентность (7 класс)
Валентность (7 класс) Классификация органических реакций, реагентов
Классификация органических реакций, реагентов Незаменимая уксусная кислота
Незаменимая уксусная кислота Валентность. Валентные возможности атомов
Валентность. Валентные возможности атомов Классы неорганических веществ
Классы неорганических веществ Критерии оценки качества природного газа
Критерии оценки качества природного газа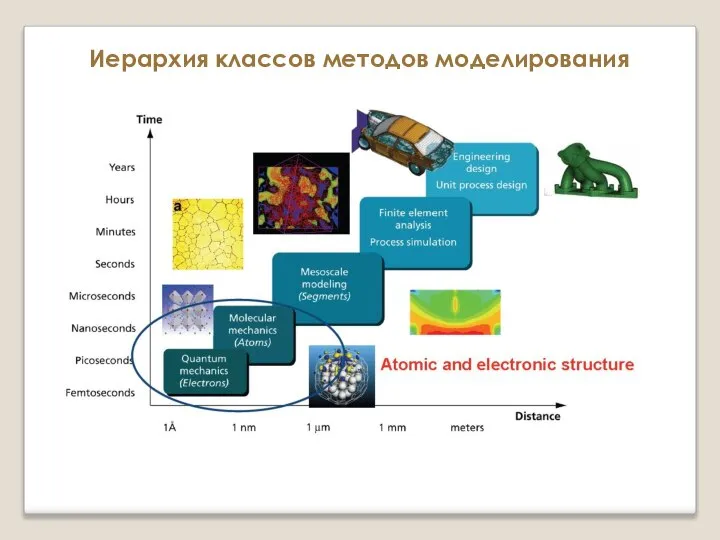 Иерархия классов методов моделирования. Атомистические и микроскопические методы
Иерархия классов методов моделирования. Атомистические и микроскопические методы Распределение электронов в атомах
Распределение электронов в атомах Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Простые вещества – металлы. Общие физические свойства металлов
Простые вещества – металлы. Общие физические свойства металлов Substanță chimică
Substanță chimică Методы разделения и очистки веществ
Методы разделения и очистки веществ Альдегиды
Альдегиды Тема: «Первоначальные сведения о строении вещества»
Тема: «Первоначальные сведения о строении вещества» Генетические ряды углеводородов. Обобщение и систематизация знаний
Генетические ряды углеводородов. Обобщение и систематизация знаний Свободные атомы. Простые вещества. Сложные вещества
Свободные атомы. Простые вещества. Сложные вещества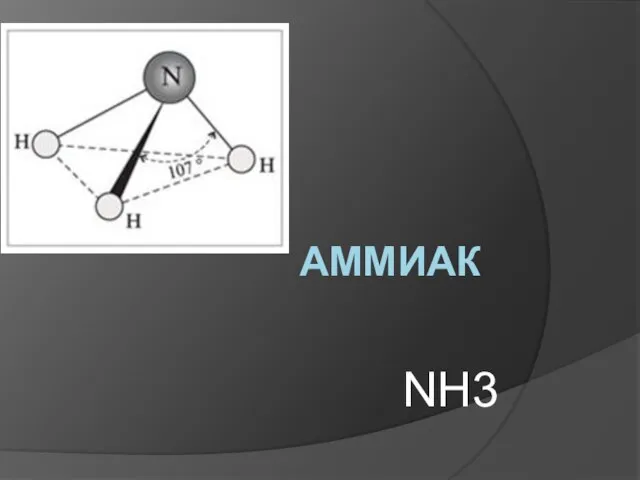 Аммиак NH3
Аммиак NH3 Алюминий и сплавы алюминия
Алюминий и сплавы алюминия Жиры – биологически важные органические соединения
Жиры – биологически важные органические соединения Удельная теплота сгорания
Удельная теплота сгорания