Слайд 2Окислительно-восстановительные свойства
H2SO3
H2SO3+Br2+H2O=H2SO4+2HBr
H2SO3+2H2S=3S+3H2O
H2SeO3
H2SeO3+4HCl(конц)=Se+2Cl2+3H2O
H2SeO3+E2+H2O=H2SeO3+2HE, E=Cl;Br;
H2TeO3
H2TeO3+4HCl(конц)=Te+2Cl2+3H2O
5H2TeO3+2HClO(конц)+9H2O=5H6TeO6+Cl2

Слайд 4Получение H2Se и H2Te, особенности поведения
H2Se – газ с неприятным запахом, токсичен
Se+2H(HClразб.,Mg)=H2Se

(комн)
Na2Se+H2O(влага)=2NaOH+H2Se
Na2Se+2HCl=2NaCl+H2Se↑
Al2Se3+6H2O=2Al(OH)3+3H2Se↑
Но H2Se=H2+Se (до 300C)
H2Se(р)=H2+Se (комн.)
2H2Se(р)+O2(воздух)=2H2O+2Se (комн.)
H2Se+NaOH=NaHSe+H2O
t(плавл.)= -65C, t(кип.)= -41C
Слайд 5H2Te – газ с неприятным запахом, токсичен
K2Te+2HCl=2KCl+H2Te (холод)
Te+2H(HCl,Al)=H2Te (0С)
2Te+2H2O(H2SO4)=2H2Te↑+O2↑ (0C) - электролиз
Но

H2Te=Te+H2 (выше 20С)
H2Te(p)=H2+Te (комн.)
2H2Te+O2(воздух)=2H2O+2Te (комн.)
t(плав)=-49C; t(кип)=-2C
Слайд 6Почему сероводород не осаждает сульфид марганца, но осаждает сульфид меди?
Диссоциация:
MnS Mn(+2)+S(-2)
CuS Cu(+2)+S(-2)
H2S

2H(+)+S(-2)
Возможные реакции:
S(-2)+Cu(+2) CuS
S(-2)+Mn(+2) MnS
S(-2)+2H(+) H2S
ПР(MnS)=2,5*10^(-10)
ПР(CuS)=6*10^(-36)
Kд(H2S)=6*10^(-22)
ПР(MnS)>K(H2S) - не осаждается
ПР(CuS)
Слайд 7Закончите уравнение реакции и подберите коэффициенты
S+KMnO4+H2SO4=MnSO4+K2SO4+SO2+H2O
S+K(+)+MnO4(-)+2H(+)+SO4(2-)=Mn(+2)+SO4(2-)+2K(+)+SO4(2-)+SO2+H2O
MnO4(-)+8H(+)+5e=Mn(+2)+4H2O 4
S+2H2O-4e=SO2+4H(+) 5
5S+10H2O+4MnO(-)+32H(+)=4Mn(+2)+16H2O+5SO2+20H(+)
5S+4MnO4(-)+12H(+)=4Mn(+2)+5SO2+6H2O
5S+4KMnO4+6H2SO4=4MnSO4+2K2SO4+5SO2+6H2O






 Elektroliz_Gidroliz
Elektroliz_Gidroliz Основания. Формулы двух амфотерных оксидов
Основания. Формулы двух амфотерных оксидов Окислительно-восстановительные реакции. Типы химических реакций
Окислительно-восстановительные реакции. Типы химических реакций Презентация на тему Химический алфавит
Презентация на тему Химический алфавит  Методы диагностики плазмы
Методы диагностики плазмы Реакции ионного обмена
Реакции ионного обмена Растворы вокруг нас
Растворы вокруг нас Классификация неорганических веществ
Классификация неорганических веществ Алмашу реакциясе
Алмашу реакциясе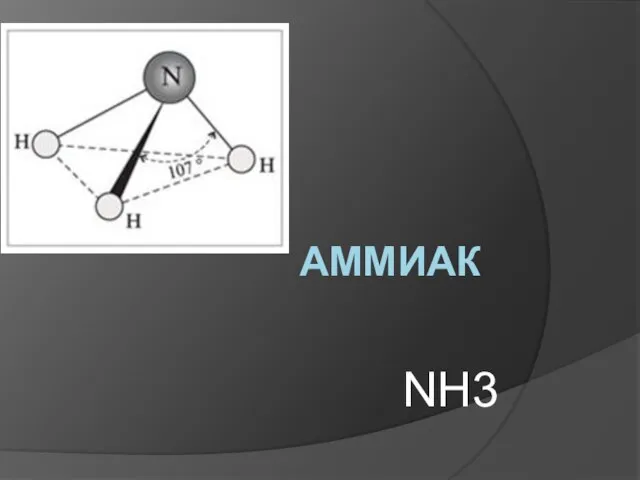 Аммиак NH3
Аммиак NH3 Презентация на тему Кристаллические решетки
Презентация на тему Кристаллические решетки  Определение качества дизельного топлива
Определение качества дизельного топлива Изменение агрегатных состояний вещества
Изменение агрегатных состояний вещества Презентация на тему Знаешь ли ты классы неорганических веществ
Презентация на тему Знаешь ли ты классы неорганических веществ  Карбоновые кислоты
Карбоновые кислоты Комментарии к выполненным заданиям по темам растворы и электролитическая диссоциация. 8 класс
Комментарии к выполненным заданиям по темам растворы и электролитическая диссоциация. 8 класс Азотосодержащие органические соединения
Азотосодержащие органические соединения Изомерия и ее виды
Изомерия и ее виды Соединения щелочных металлов
Соединения щелочных металлов Металлы и их соединения
Металлы и их соединения Химический элемент калий
Химический элемент калий Презентация на тему Подгруппа углерода
Презентация на тему Подгруппа углерода  Комплексонометрия. Способы комплексонометрического титрования
Комплексонометрия. Способы комплексонометрического титрования Амфотерные соединения Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водоро
Амфотерные соединения Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водоро Валентность. Составление формул по валентности
Валентность. Составление формул по валентности Массовая доля растворённого вещества
Массовая доля растворённого вещества Природный источник нефть
Природный источник нефть Химический элемент. Изотопы. Ионы
Химический элемент. Изотопы. Ионы