Содержание
- 2. Атом – «неделимый» Делимость атома доказывают явления: Фотоэффекта Радиоактивности Электролиза
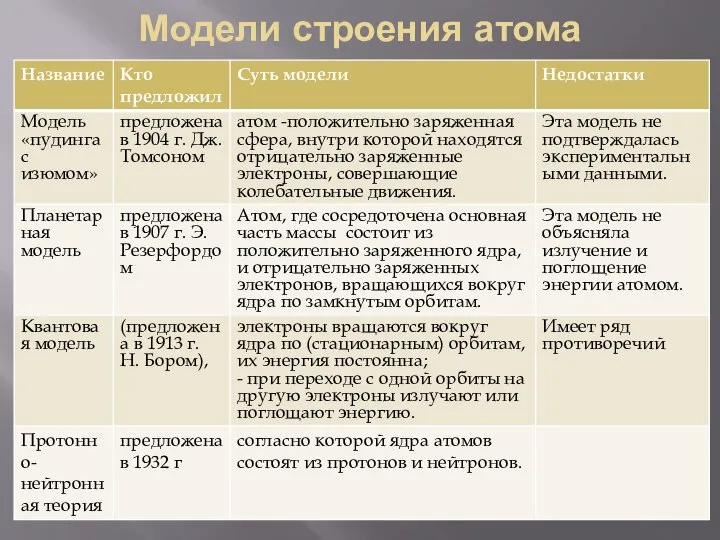
- 3. Модели строения атома
- 4. Модели атома Модель атома Томсона Модель атома Резерфорда Модель атома Бора
- 5. Модель атома Томсона «Пудинг с изюмом» Джозеф Томсон (1856 -1940), английский учёный, в 1897г. открыл электрон,
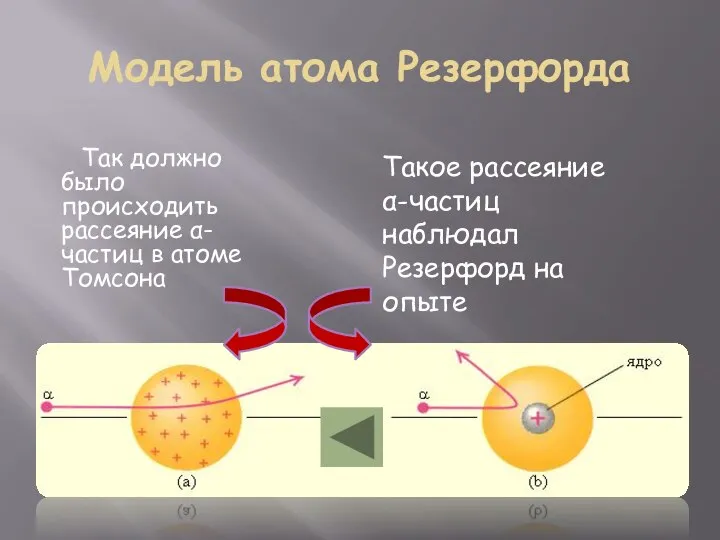
- 6. Модель атома Резерфорда Так должно было происходить рассеяние α-частиц в атоме Томсона Такое рассеяние α-частиц наблюдал
- 7. - Сравнение размеров ядра и электрона Сравните соотношение размеров ядра и электрона в атоме
- 8. Модель атома Бора 1 постулат: Электрон может вращаться вокруг ядра не по любым, а только по
- 9. Корпускулярно-волновые свойства микромира Элементарные частицы имеют ничтожно малые массы и размеры, поэтому обладают особыми свойствами. Квантовая
- 10. Протонно-нейтронная теория В 1932 г была разработана протонно-нейтронная теория строения атомного ядра. Итак: Ядро состоит из
- 11. Модели строения атома
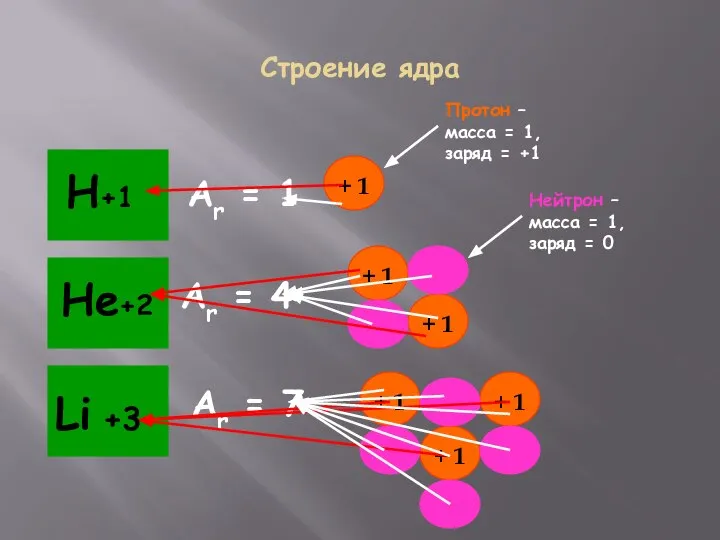
- 12. Строение ядра Аr = 1 Аr = 4 Аr = 7 Протон – масса = 1,
- 13. Что произойдет, если изменится число протонов в ядре? Изменение числа протонов в ядре приведет к образованию
- 14. Что произойдет, если изменится число нейтронов в ядре атома? Изменение числа нейтронов в атоме приведет к
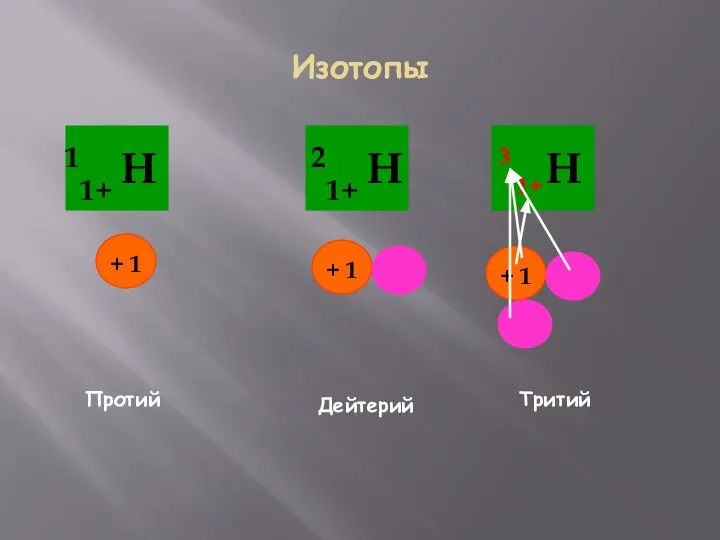
- 15. Изотопы Протий Дейтерий Тритий 1+ 3
- 16. Повторим Какие модели строения атома Вам известны? В чем их несостоятельность? Какие постулаты предложил Н. Бор?
- 17. СОСТОЯНИЕ ЭЛЕКТРОНА В АТОМЕ Квантовые числа. Принципы заполнения электронных оболочек атомов электронами.
- 18. Важнейшие понятия Состояние электрона в атоме - это совокупность информации об энергии определенного электрона и пространстве,
- 19. Электронное облако
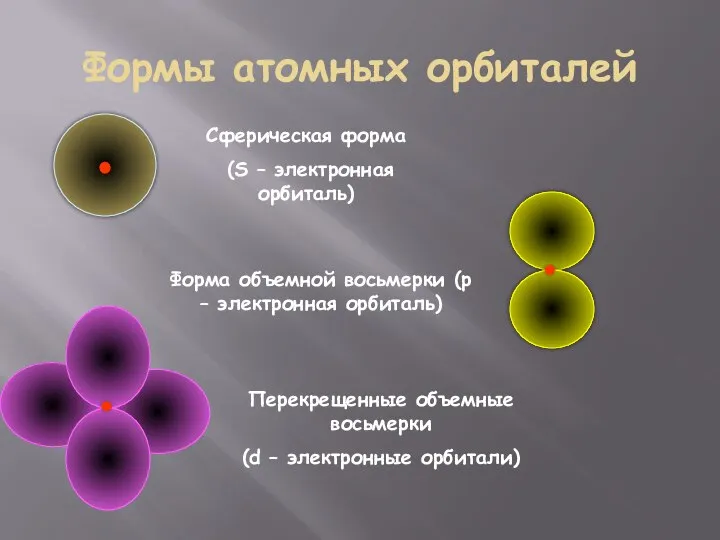
- 20. Формы атомных орбиталей Сферическая форма (S – электронная орбиталь) Форма объемной восьмерки (p – электронная орбиталь)
- 21. Квантовые числа Совокупность сложных движений электрона в атоме характеризуются квантовыми числами. Различают: n – главное квантовое
- 22. Главное квантовое число (n) Характеризует общую энергию электрона данного энергетического уровня. Принимает целые значения: 1,2,3… Главное
- 23. Побочное квантовое число (l) Характеризует запас энергии электрона в пределах энергетического уровня. Принимает значения от 0
- 24. Магнитное квантовое число ml Характеризует распределение орбиталей в магнитном поле ядра. Зависит от побочного квантового числа.
- 25. Магнитное спиновое квантовое число (ms) Это собственный момент импульса электрона. Может принимать значения: -1/2 или +1/2
- 26. Задание Опишите состояние электронов в атоме химического элемента №8, используя все квантовые числа.
- 27. Принципы заполнения электронных оболочек Принцип наименьшей энергии. Принцип Паули. Правило Хунда Правило Клечковского. Задание: Напишите электронную
- 28. Принцип наименьшей энергии Электрон занимает тот энергетический уровень, тот подуровень, ту атомную орбиталь, которым соответствует минимальный
- 29. Принцип Паули В одном и том же атоме не может быть двух электронов, обладающих одинаковым набором
- 30. Правило Хунда Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное спиновое
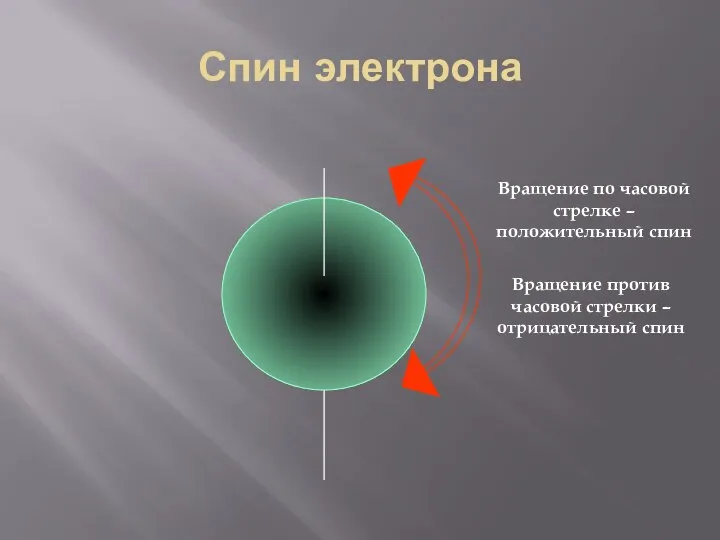
- 31. Спин электрона Вращение по часовой стрелке – положительный спин Вращение против часовой стрелки – отрицательный спин
- 32. Правило Клечковского Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантового
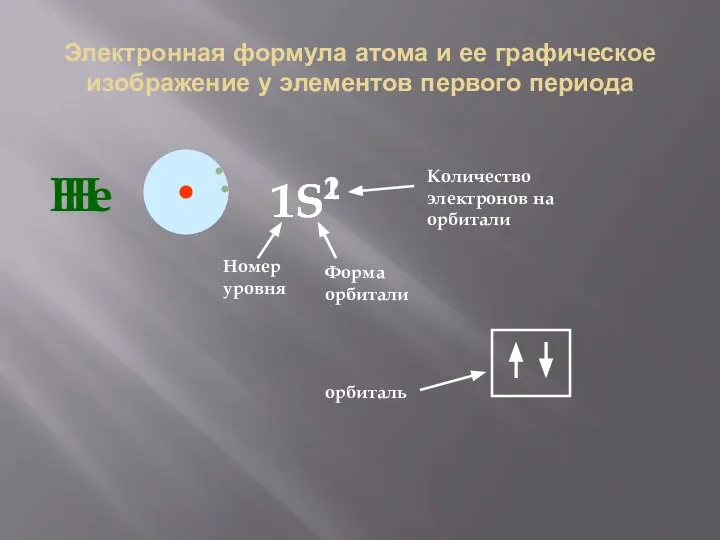
- 33. Электронная формула атома и ее графическое изображение у элементов первого периода Н 1S1 Номер уровня Форма
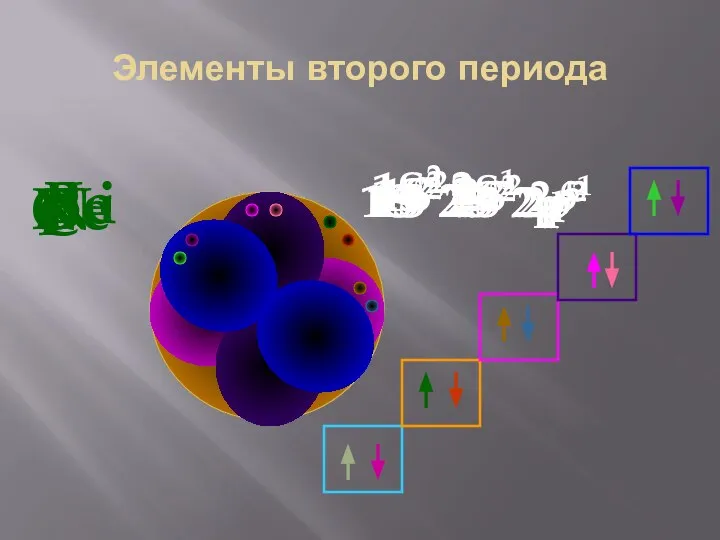
- 34. Элементы второго периода Li 1S2 2S1 Be 1S2 2S2 B 1S2 2S2 2p1 C 1S2 2S2
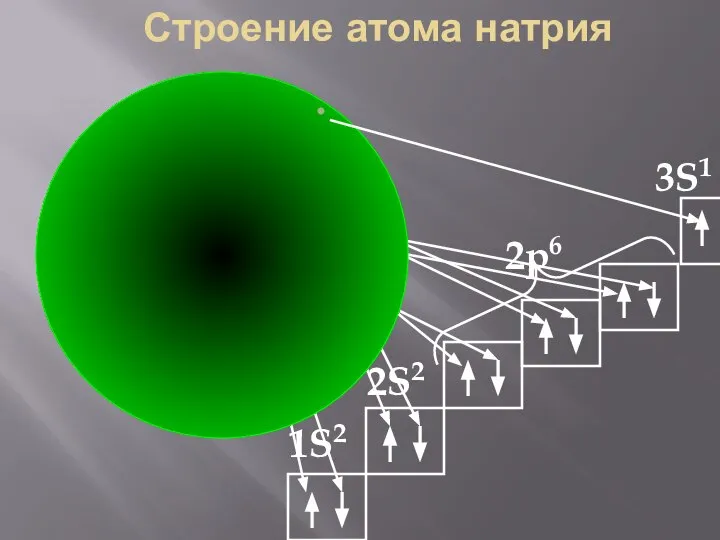
- 35. Na Строение атома натрия 2S2 2p6 3S1 1S2
- 37. Скачать презентацию

























 Алкены
Алкены Еще раз про электролиз…
Еще раз про электролиз… Сырье, продукты, параметры гидроочистки
Сырье, продукты, параметры гидроочистки Основы МКТ
Основы МКТ Сутек өндірісінің болашақ технологиясы - фотокатализ
Сутек өндірісінің болашақ технологиясы - фотокатализ Презентация на тему Карбоновые кислоты и их производные
Презентация на тему Карбоновые кислоты и их производные  Химическая кинетика и равновесие
Химическая кинетика и равновесие Обобщение знаний по теме атомы химических элементов. Химическая связь
Обобщение знаний по теме атомы химических элементов. Химическая связь Свине́ц (Plumbum;Pb)
Свине́ц (Plumbum;Pb) Химия. Электролитическая диссоциация. (9 класс)
Химия. Электролитическая диссоциация. (9 класс) Презентация Продукции Opet (3)
Презентация Продукции Opet (3) Кислород
Кислород Органические вещества клетки. Липиды. (10 класс)
Органические вещества клетки. Липиды. (10 класс) Физические и фазовые состояния полимеров
Физические и фазовые состояния полимеров Алкины: получение и применение
Алкины: получение и применение Реакционная система. Схема химической реакции. Закон сохранения массы веществ в химической реакции
Реакционная система. Схема химической реакции. Закон сохранения массы веществ в химической реакции Сернистый ангидрид SO2. Диоксид серы
Сернистый ангидрид SO2. Диоксид серы Ароматические гетероциклические соединения
Ароматические гетероциклические соединения Алкены (CnH2n)
Алкены (CnH2n) Типы химической связи и виды кристаллических решеток
Типы химической связи и виды кристаллических решеток Теория валентных связей
Теория валентных связей Минералы алюминия
Минералы алюминия Ароматические углеводороды
Ароматические углеводороды Повторение по химии (8 класс)
Повторение по химии (8 класс) Презентация на тему Халькогены
Презентация на тему Халькогены  Презентация на тему Электролитическая диссоциация (8 класс)
Презентация на тему Электролитическая диссоциация (8 класс)  Вода И её значение
Вода И её значение Выращивание кристаллов медного купороса с использованием воды различной степени очистки
Выращивание кристаллов медного купороса с использованием воды различной степени очистки