Содержание
- 2. Азот – значит «безжизненный», но, по мнению Д.И Прянишникова, «Нет жизни без азота, ибо он является
- 3. План изучения элемента История открытия. Строение атома. Строение молекулы азота. Физические свойства. Химические свойства. Круговорот азота
- 4. История открытия Азот был открыт почти одновременно несколькими исследователями в 1772 году. Из за того, что
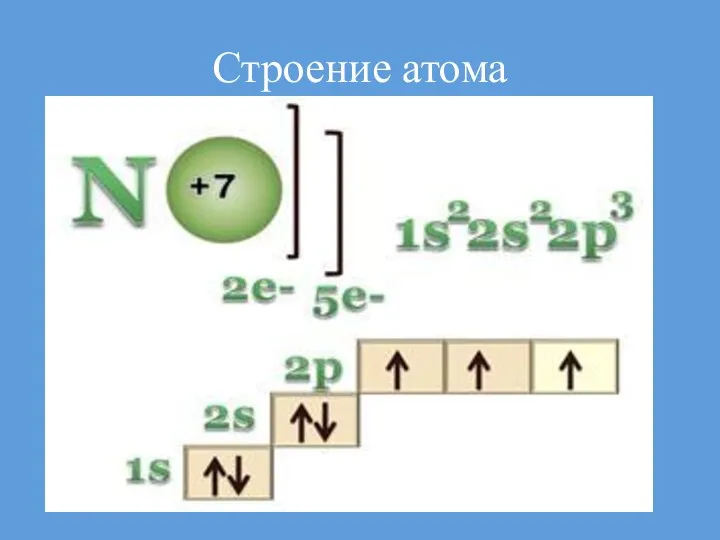
- 5. Строение атома
- 6. Строение молекулы азота
- 7. Физические свойства Азот немного легче воздуха; плотность 1,2506 кг/м3 (при н.у.), tпл.= - 209,8оС, tкип.= -195,8оС.
- 8. Химические свойства Окислительные свойства Взаимодействие с металлами При обычных условиях молекулярный азот реагирует лишь с некоторыми
- 9. Взаимодействие с водородом Реакция с водородом протекает при температуре порядка 400 °С и давлении 200 атм
- 10. Восстановительные свойства Взаимодействие с кислородом Только под действием электрического разряда азот реагирует с кислородом: O2 +
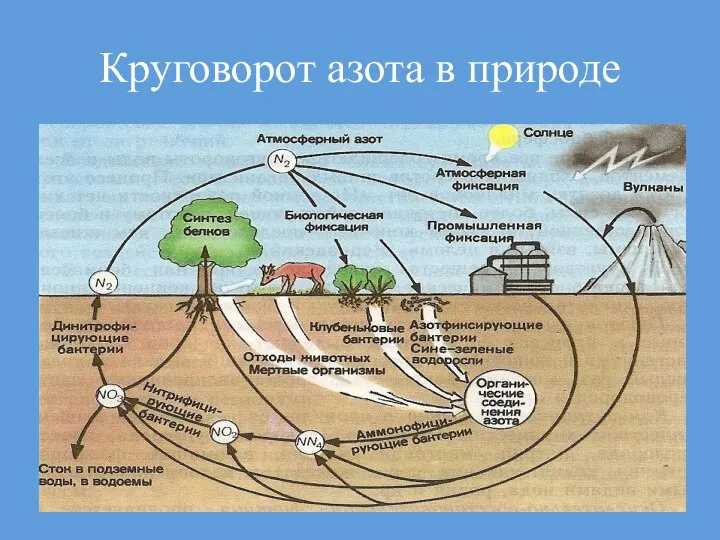
- 11. Круговорот азота в природе
- 12. Биологическое значение Азот - элемент-органоген, без которого жизнь невозможна, поскольку в состав аминокислот, образующих белки, входит
- 13. Применение Азот применяется при производстве минеральных удобрений Для синтеза аммиака Создания инертной атмосферы в лампах Используется
- 15. Скачать презентацию










 Карбоцепные полимеры
Карбоцепные полимеры 9-14 Реакции в растворах электролитов
9-14 Реакции в растворах электролитов Презентация на тему Химические свойства оксидов
Презентация на тему Химические свойства оксидов  Химическое равновесие
Химическое равновесие Калийные удобрения. Лекция 28
Калийные удобрения. Лекция 28 Ovr-1
Ovr-1 Металлургия
Металлургия Теория строения органических соединений
Теория строения органических соединений Предмет химии. Вещества
Предмет химии. Вещества Основы химии полимеров
Основы химии полимеров Хімічний експеримент
Хімічний експеримент Теплота растворения
Теплота растворения Арены. Бензол
Арены. Бензол 8_ANIONY_2_3_angr
8_ANIONY_2_3_angr Аммиак. Соли аммония
Аммиак. Соли аммония Альдегиды и кетоны
Альдегиды и кетоны Кислоты. К уроку по химии для 8 класса
Кислоты. К уроку по химии для 8 класса Растворение веществ в воде. Лабораторный опыт № 5 Изучение растворимости веществ
Растворение веществ в воде. Лабораторный опыт № 5 Изучение растворимости веществ Образование химических связей
Образование химических связей Презентация на тему Арены (10 класс)
Презентация на тему Арены (10 класс)  Харктеристика металлов
Харктеристика металлов Презентация на тему Сложные вопросы ЕГЭ по химии
Презентация на тему Сложные вопросы ЕГЭ по химии  Валентность
Валентность Substanță chimică
Substanță chimică Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Органическая химия. Классификация. Номенклатура
Органическая химия. Классификация. Номенклатура Неметаллические материалы
Неметаллические материалы Растворы и их концентрация. Массовая доля растворенного вещества
Растворы и их концентрация. Массовая доля растворенного вещества