Содержание
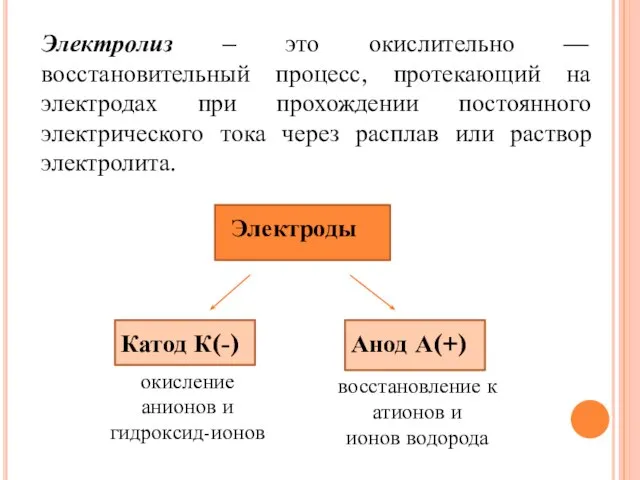
- 2. Электролиз – это окислительно — восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через
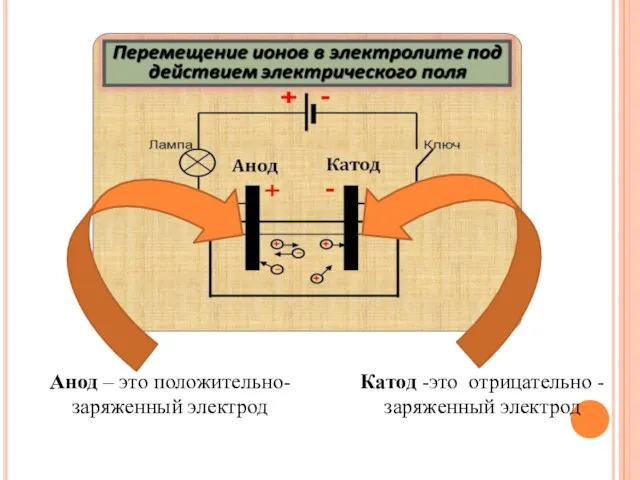
- 3. Катод -это отрицательно - заряженный электрод Анод – это положительно- заряженный электрод
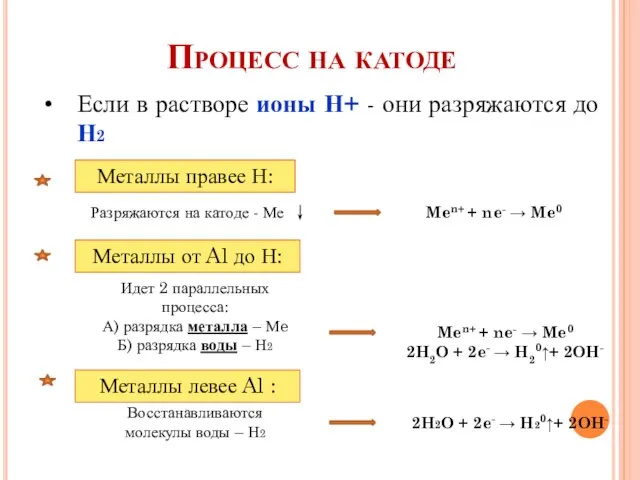
- 4. Процесс на катоде Если в растворе ионы Н+ - они разряжаются до Н2 Металлы правее Н:
- 5. Процесс на аноде если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в
- 6. Анионы бескислородных кислот (кроме F-) Разряжаются до простого вещества: S2-, I-, Br-, СI- Анионы кислородсодержащих кислот
- 7. Анионы карбоновых кислот – реакция Кольбе Происходит процесс декарбоксилирования и выделяется алкан 2СН3СОО- - 2е- →
- 8. 1. Анод нерастворимый (например, графитовый) Суммарное уравнение: Учитывая присутствие ионов Na в растворе: Пример №1.
- 9. Суммарное ионное уравнение: Суммарное молекулярное уравнение: Пример №2.
- 10. 2. Анод растворимый (например, медный) Если анод растворимый, то металл анода будет окисляться: Катионы Cu2+ в
- 11. Алгоритм составления уравнений электролиза:
- 12. Проверь себя… Задания на электролиз
- 13. При электролизе водного раствора хлорида лития (LiCL) на аноде в результате электролиза образуется: 1) хлор 2)
- 14. При электролизе водного раствора хлорида лития (LiCL) на аноде в результате электролиза образуется: 1) хлор 2)
- 15. Задание 3 Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного
- 16. Задание 4 Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного
- 17. Задание 5 Установите соответствие между веществом и продуктами его электролиза в растворе или расплаве: к каждой
- 18. Задание 6 Вычислите объём в литрах газа, выделяющегося на аноде при электролизе водного раствора гидроксида кальция
- 19. Задание 7 Какая масса (в граммах) гидроксида лития образуется в растворе при электролизе водного раствора хлорида
- 21. Скачать презентацию















 Бензол
Бензол Физико-химические свойства растворов ВМС
Физико-химические свойства растворов ВМС Гидроксикарбоновые кислоты
Гидроксикарбоновые кислоты Этиленовые углеводороды
Этиленовые углеводороды Презентация на тему Химический элемент - водород
Презентация на тему Химический элемент - водород  Ковалентная химическая связь
Ковалентная химическая связь Презентация на тему Коррозия металлов
Презентация на тему Коррозия металлов  Алкины. Ацетилен
Алкины. Ацетилен История создания периодической таблицы
История создания периодической таблицы Сложные вещества кислоты
Сложные вещества кислоты Лиофильные и лиофобные дисперсные системы. Свойства лиофильных систем. Лекция 12
Лиофильные и лиофобные дисперсные системы. Свойства лиофильных систем. Лекция 12 Исследование кокаина методом ГХ-МС
Исследование кокаина методом ГХ-МС Выбраковка результатов химического анализа
Выбраковка результатов химического анализа Reactivi444
Reactivi444 Химическое равновесие
Химическое равновесие Nanotechnology (theoretical part)
Nanotechnology (theoretical part) Гетерофункциональные органические соединения
Гетерофункциональные органические соединения Презентация на тему Роль химии в жизни человека
Презентация на тему Роль химии в жизни человека  Химический опыт с горением борноэтилового эфира
Химический опыт с горением борноэтилового эфира Галогены
Галогены Катализ в нефтепереработке
Катализ в нефтепереработке Циклоалканы
Циклоалканы Алюминий и его свойства
Алюминий и его свойства Химическая связь 11 класс - Презентация_
Химическая связь 11 класс - Презентация_ Физическая химия. Лекция 1. Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической
Физическая химия. Лекция 1. Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической Алканы
Алканы Межмолекулярные взаимодействия (лекция 4)
Межмолекулярные взаимодействия (лекция 4) Ионообменная хроматография
Ионообменная хроматография