Содержание
- 2. Цели урока: Рассмотреть свойства и применение важнейших соединений галогенов. Изучить качественные реакции на галогенид-ионы. Рассмотреть свойства
- 3. Основное содержание Понятие о галогеноводородах Галогеноводородные кислоты Оксокислоты Галогениды.(соли) Значение соединений галогенов.
- 4. Соединения галогенов Галогеноводороды, – Это едкие газы с резким запахом, хорошо раствормые в воде HF HCl
- 5. Получение хлороводорода NaСl(тв) + Н2SО4(конц) = НСl↑ + КНSО4.
- 6. Галогеноводородные кислоты Образуются при растворении галогеноводородов в воде. HF HCl HBr HI Фтороводородная кислота ( плавиковая)
- 7. Оксокислоты Хлорная – НСlO4 Сl2O7 Хлорноватая – НСlO3 Сl2O5 Хлористая – НСlO2 Сl2O3 Хлорноватистая- НСlO Сl2O
- 8. Соли Фториды Хлориды Бромиды Йодиды Галогениды Na F KCl KBr NaI
- 9. Качественная реакция на галогенид - ионы Взаимодействие с ионом серебра: (AgNO3) AgNO3 + KCl = KNO3
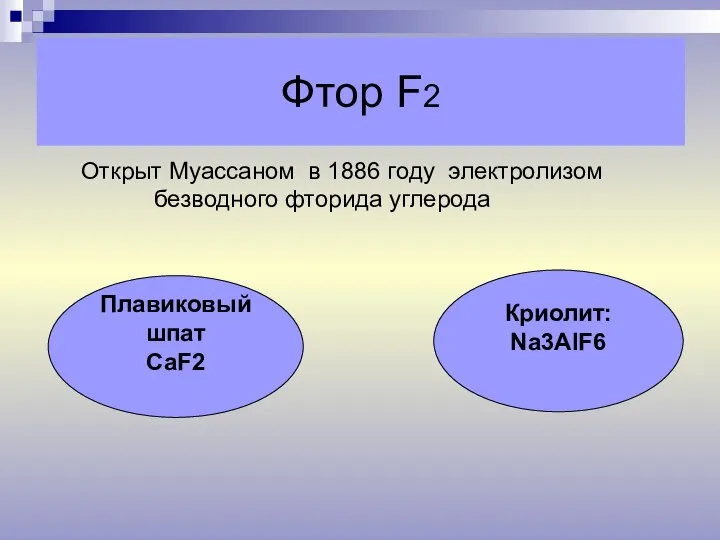
- 10. Фтор F2 Открыт Муассаном в 1886 году электролизом безводного фторида углерода Плавиковый шпат СаF2 Криолит: Na3AlF6
- 11. Соединения фтора n(-CF2-CF2-) Тефлон устойчив к действию всех известных кислот и их смесей. Он выдерживает температуры
- 12. Галит (NaCl ) Хлор ДДТ (дихлородифенилтрихлорэтан) KClO3 - Бертолетова соль. 2KClO3 + 3S = 2KСl +
- 13. AgBr- фотография NaBr- дубление кожи KBr- линзы LiBr- используется в кондиционерах. Бром
- 14. Получил Б.Куртуа. (1811 г) 2NaI + 2H2SO4 = I2 + SO2↑ + Na2SO4 + 2H2O 3I2
- 16. Скачать презентацию












 Химические реакции
Химические реакции Классы неорганических соединений
Классы неорганических соединений Кристаллогидраты
Кристаллогидраты Конкурс юных химиков
Конкурс юных химиков Материаловедение. Строение металлических материалов. Металлические сплавы
Материаловедение. Строение металлических материалов. Металлические сплавы Электрический ток в металлах
Электрический ток в металлах Технология производства пленок. Свойства полимерных пленочных материалов, модификация, применение
Технология производства пленок. Свойства полимерных пленочных материалов, модификация, применение Ķīmiskais līdzsvars un faktori, kas to ietekmē
Ķīmiskais līdzsvars un faktori, kas to ietekmē Неметаллы в природе и жизни человека
Неметаллы в природе и жизни человека Презентация на тему Удобрения и их классификация
Презентация на тему Удобрения и их классификация  Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами
Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами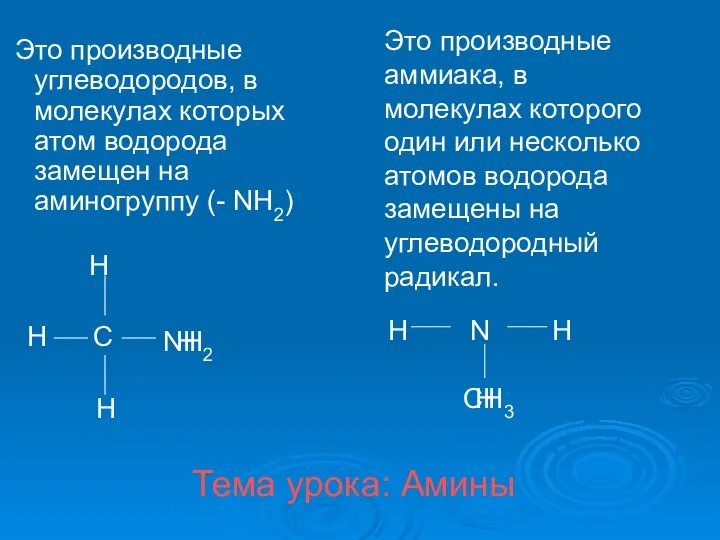 Амины. Классификация аминов
Амины. Классификация аминов Коррозия металлов и борьба с ней. Лабораторная работа
Коррозия металлов и борьба с ней. Лабораторная работа Dereglarea metabolismului
Dereglarea metabolismului Презентация на тему Обратимость химических реакций. Химическое равновесие
Презентация на тему Обратимость химических реакций. Химическое равновесие  Соль и ее свойства. Добыча соли
Соль и ее свойства. Добыча соли Кислоты. состав, номенклатура и их их классификация
Кислоты. состав, номенклатура и их их классификация Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества
Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества Свойства воды
Свойства воды Протравка стекла с помощью ионного обмена
Протравка стекла с помощью ионного обмена Интеллектуальная игра по химии Металлы
Интеллектуальная игра по химии Металлы Витамины. (10 класс)
Витамины. (10 класс) Состав и свойства нефти
Состав и свойства нефти Соединения железа в природе
Соединения железа в природе 9 кл Урок 7 Розчинність речовин
9 кл Урок 7 Розчинність речовин Химическая связь и строение вещества
Химическая связь и строение вещества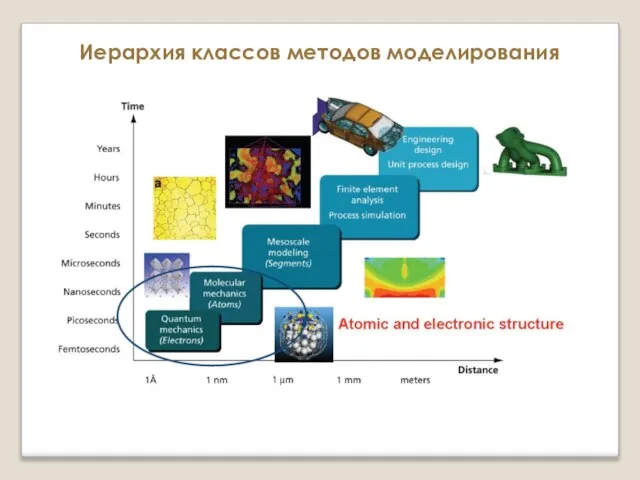 Атомистическое моделирование
Атомистическое моделирование Физическая химия
Физическая химия