Содержание
- 2. Строение и свойства атомов
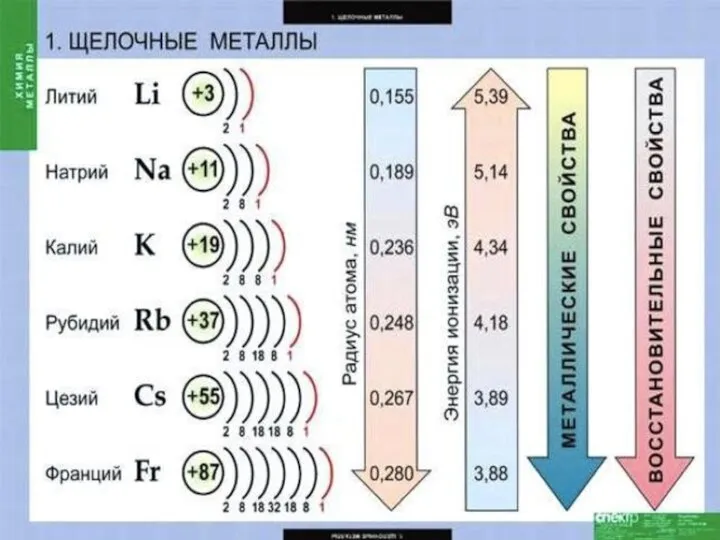
- 3. Щелочные металлы — это элементы главной подгруппы I группы : литий Li, натрий Nа, калий К,
- 5. На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемуся на сравнительно большом удалении
- 6. Щелочные металлы - простые вещества
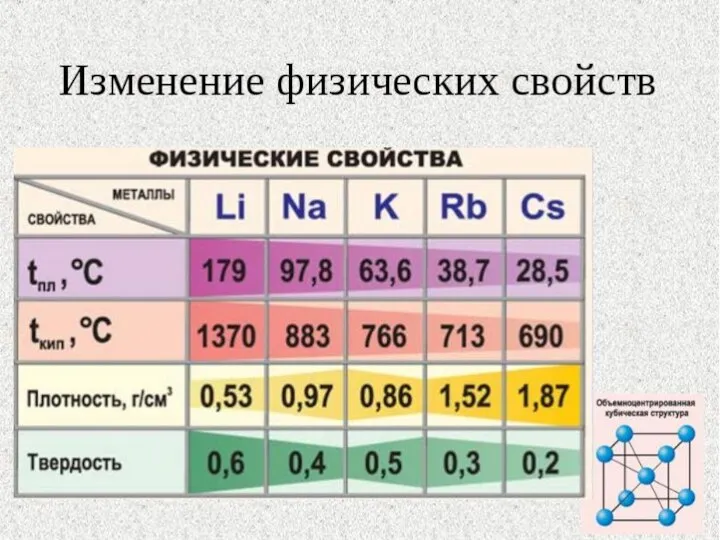
- 7. Серебристо-белые мягкие вещества (режутся ножом), с характерным блеском на свежесрезанной поверхности. Все они легкие и легкоплавкие,
- 9. Химические свойства
- 10. Все щелочные металлы чрезвычайно активны, во всех химических реакциях проявляют восстановительные свойства, отдают свой единственный валентный
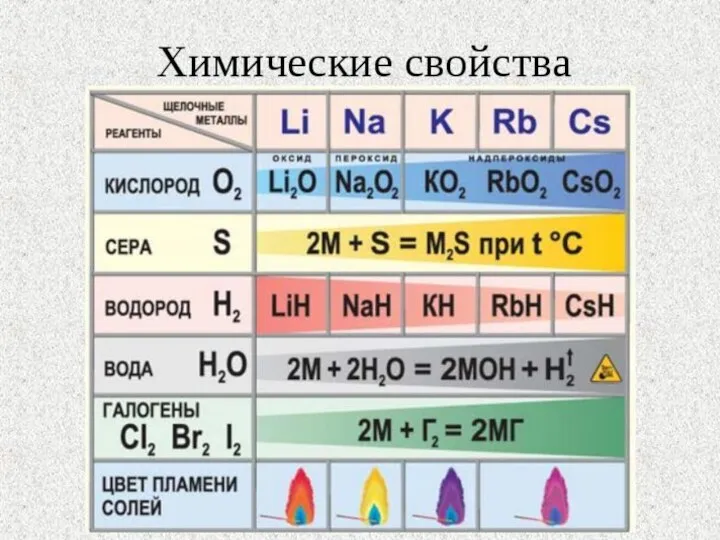
- 12. Взаимодействие с неметаллами
- 13. Щелочные металлы легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность: оксид образует только литий:
- 14. Взаимодействие с водородом, серой, фосфором, углеродом, кремнием протекает при нагревании: с водородом образуются гидриды: 2Na +
- 15. С азотом легко реагирует только литий, реакция протекает при комнатной температуре с образованием нитрида лития: 6Li
- 16. Взаимодействие с водой
- 17. Все щелочные металлы реагируют с водой, литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется,
- 18. Щелочные металлы способны реагировать с разбавленными кислотами с выделением водорода, однако реакция будет протекать неоднозначно, поскольку
- 19. Соединения щелочных металлов В свободном виде в природе щелочные металлы не встречаются из-за своей исключительно высокой
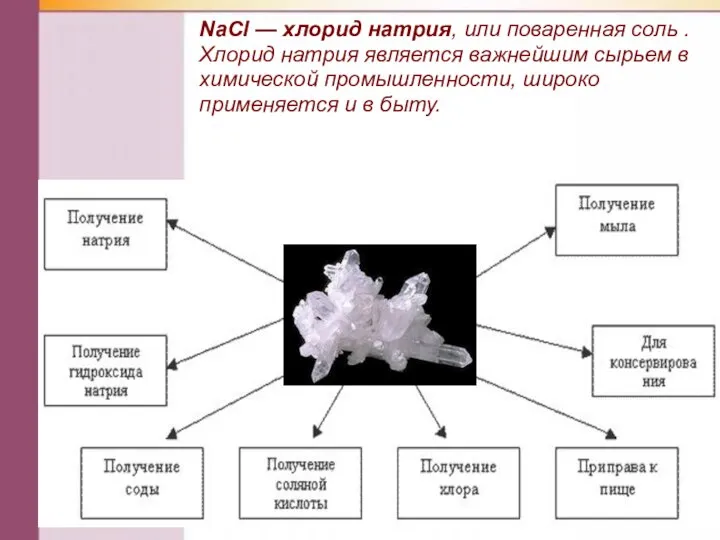
- 21. NаСl — хлорид натрия, или поваренная соль . Хлорид натрия является важнейшим сырьем в химической промышленности,
- 23. Скачать презентацию
















 Химическая промышленность России входит в авангардную тройку
Химическая промышленность России входит в авангардную тройку Составление формул по валентности
Составление формул по валентности Ртуть. Правила работы со ртутью
Ртуть. Правила работы со ртутью Нефть и основные продукты её переработки
Нефть и основные продукты её переработки lll-l группы главные подгруппы. 11 класс
lll-l группы главные подгруппы. 11 класс Ионообменная хроматография в разделении белков
Ионообменная хроматография в разделении белков Магний и его сплавы
Магний и его сплавы Получение и применение алканов (10 класс)
Получение и применение алканов (10 класс) Электролиз воды
Электролиз воды Исследование растворимости в системе уксусная кислота-этиловый спирт-этилацетат-вода методом изотермического титрования при 60˚C
Исследование растворимости в системе уксусная кислота-этиловый спирт-этилацетат-вода методом изотермического титрования при 60˚C Фторопласты и их использование
Фторопласты и их использование Теория электролитической диссоциации
Теория электролитической диссоциации Нанокристаллические и аморфные металлы и сплавы
Нанокристаллические и аморфные металлы и сплавы Скорость химических реакций
Скорость химических реакций Презентация на тему М.В. Ломоносов
Презентация на тему М.В. Ломоносов  Фосфор. Элемент жизни и мысли
Фосфор. Элемент жизни и мысли Хлордың қолданылуы
Хлордың қолданылуы Теория растворов. (Тема 1.5)
Теория растворов. (Тема 1.5) Презентация на тему Волокна
Презентация на тему Волокна  Химические элементы, входящие в состав питательных веществ
Химические элементы, входящие в состав питательных веществ Вода – самое удивительное вещество на Земле
Вода – самое удивительное вещество на Земле Презентация на тему Вредное воздействие нитратов на организм человека
Презентация на тему Вредное воздействие нитратов на организм человека  Презентация на тему Химия наука о веществах
Презентация на тему Химия наука о веществах  10.1С_Серная кислота
10.1С_Серная кислота Полимеры. Функции полимеров
Полимеры. Функции полимеров Роль нитрадов. Взгляд специалистов
Роль нитрадов. Взгляд специалистов ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы
ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы Презентация на тему Химия моя профессия
Презентация на тему Химия моя профессия