Слайд 2
С точки зрения теории электролитической диссоциации:
Элекролиты – это вещества, растворы

и/или
расплавы которых проводят электрический ток
( кислоты, основания, соли).
Электролиты в растворах и расплавах подвергаются процессу электролитической диссоциации- распаду молекул на ионы.
Слайд 3 Количественной характеристикой способности электролита распадаться на ионы является величина
степени диссоциации

электролита (α),
которая показывает отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул электролита
α = Nион | N раств
Слайд 4 По величине α электролиты классифицируют на :
Сильные электролиты: α ˃ 0,3

(больше 30 %)
2. Средней силы электролиты 0,3 ˃ α ˃ 0,03
(от 3 до 30 %)
3. Слабые электролиты α ˂ 0,03 (меньше 3%)
Слайд 5 Константа диссоциации электролита определяется законом действующих масс: К А ↔ К+ +
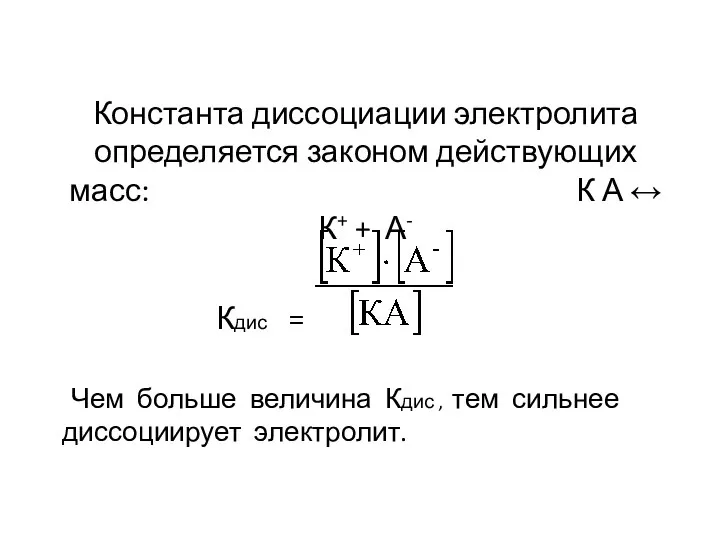
А-
Кдис =
Чем больше величина Кдис , тем сильнее диссоциирует электролит.
Слайд 6 Для оценки концентрационных эффектов в растворах сильных электролитов вводится величина
активности

электролита - а(Х)
Под активностью электролита Х понимают эффективную концентрацию электролита, в соответствии с которой он участвует в различных процессах.
Слайд 7Активность связана с истинной концентрацией растворенного вещества соотношением:
а (х) = f(х)·

С (х)
С(х)- концентрация электролита, моль/л
а(х)- активность электролита, моль/л
f(х)- коэффициент активности; выражает отклонение свойств раствора с концентрацией С(х) от свойств идеального бесконечно разбавленного раствора данного электролита. Принимает значения от 0 до 1.
Слайд 8
Ионной силой раствора (I ) называют величину, равную полусумме произведения

моляльной концентрации находящихся в растворе ионов на квадрат заряда каждого иона.
- моляльная концентрация ионов данного вида;
показывает содержание количества (моль) ионов в килограмме растворителя; моль/кг
– ионная сила раствора; характеризует суммарную активность ионов в растворе с учетом сил межионного взаимодействия; моль/кг
– заряд иона
Слайд 9 Для биологических систем in vivo:
Iфиз = 0,15 моль/кг
Растворы, применяемые

в медицинской практике и имеющие ионную силу равную 0,15 моль/кг называются физиологическими растворами.
Слайд 10Ионное произведение воды.
Водородный показатель среды растворов.

Слайд 11
Н2 О↔Н + + ОН-
Н2 О + Н + ↔ Н3
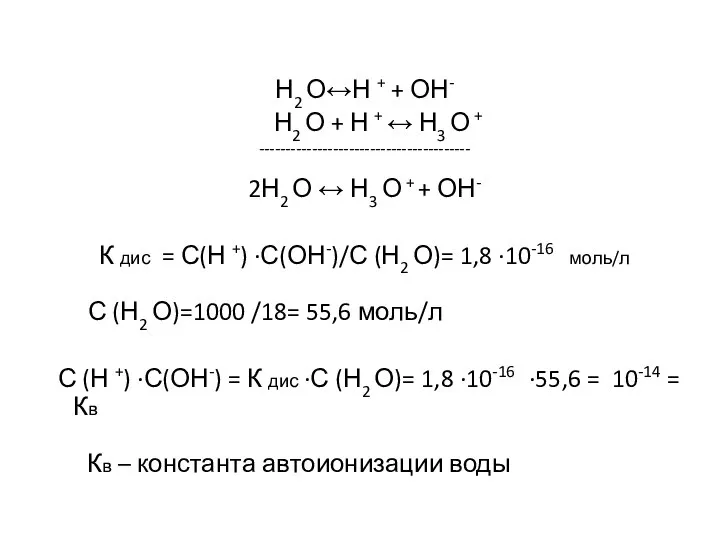
О +
----------------------------------------
2Н2 О ↔ Н3 О + + ОН-
К дис = С(Н +) ·С(ОН-)/С (Н2 О)= 1,8 ·10-16 моль/л
С (Н2 О)=1000 /18= 55,6 моль/л
С (Н +) ·С(ОН-) = К дис ·С (Н2 О)= 1,8 ·10-16 ·55,6 = 10-14 = Кв
Кв – константа автоионизации воды
Слайд 12Уравнение ионного произведения воды имеет вид:
Кв = С(Н +) ·С(ОН-)= 10-14 при

298 К
в чистой воде и растворе любого электролита при данной температуре произведение концентрации (активности) ионов водорода и гидроксид-ионов
есть величина постоянная, называемая константой автоионизации воды.
Слайд 13 В чистой дистилированной воде:
С(Н +) = С(ОН-) = 10-14 =

10-7 моль/л
По величине С(Н +) определяют реакцию среды раствора:
Нейтральная среда: С(Н +) =10-7 моль/л
Кислая среда: С(Н +) ˃ 10-7 моль/л (10-6 и т.д.)
3. Щелочная среда: С(Н +) ˂ 10-7 моль/л(10-8 и т.д.)
Слайд 14Водородный показатель среды раствора ( рН ) –
численно равен отрицательному десятичному

логарифму концентрации (активности) ионов водорода в растворе.
рН = - lg С(Н+)
Гидроксильный показатель среды раствора (рОН)-
численно равен отрицательному десятичному логарифму концентрации (активности) гидроксид-ионов в в растворе.
рОН = - lg С(ОН-)
Слайд 15
Величина рН раствора указывает на реакцию среды раствора:
Нейтральная среда: рН = 7
2.

Кислая среда: рН ˂ 7
3. Щелочная среда: рН ˃ 7
Слайд 16 Если взять отрицательный десятичный логарифм выражения ионного произведения воды, то уравнение

принимает вид:
- lg [С(Н +) ·С(ОН-) ] = - lg 10-14
[- lg С(Н +) ] + [- lg С(ОН-) ] = 14
получаем:
рН + рОН = 14















 Презентация на тему Азотная кислота и её соли
Презентация на тему Азотная кислота и её соли  Типы химических связей
Типы химических связей Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация учителя химии, биологии и экологии МОУ СОШ п.Алексеевка Бешагина Владимира Викторовича
Презентация учителя химии, биологии и экологии МОУ СОШ п.Алексеевка Бешагина Владимира Викторовича Дисперсные системы
Дисперсные системы Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность Изучение пенопласта
Изучение пенопласта Конспект по химии
Конспект по химии Силикатная промышленность
Силикатная промышленность Степень окисления. Электроотрицательность. Формулы бинарных соединений
Степень окисления. Электроотрицательность. Формулы бинарных соединений Горный хрусталь
Горный хрусталь Презентация на тему История семи великих камней Алмазного фонда России
Презентация на тему История семи великих камней Алмазного фонда России  Химия неорганическая и органическая
Химия неорганическая и органическая Метелёва И.Е. учитель химии
Метелёва И.Е. учитель химии Технология адсорбционной осушки газа
Технология адсорбционной осушки газа Пропиловый спирт C3H7OH
Пропиловый спирт C3H7OH Общие способы получения металлов
Общие способы получения металлов Сера. Немного истории
Сера. Немного истории Электролиз солей
Электролиз солей Интересные факты о меди
Интересные факты о меди Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Строение атома
Строение атома Приемы разделения мембранных липидов на классы
Приемы разделения мембранных липидов на классы Валентность. Составление формул по валентности
Валентность. Составление формул по валентности Алканы
Алканы Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона
Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона Физико-химические методы анализа. Лекция 4
Физико-химические методы анализа. Лекция 4 Равновесия в растворах электролитов. Окислительно-восстановительные реакции
Равновесия в растворах электролитов. Окислительно-восстановительные реакции