Содержание
- 2. 2. Химическая термодинамика 2.10. Термодинамические потенциалы Реакцию, протекающую при постоянном объёме V=const (в замкнутом реакторе), характеризуют
- 3. 2. Химическая термодинамика 2.10. Термодинамические потенциалы Неизолированные закрытые системы могут отдать внешней среде только часть своей
- 4. 2. Химическая термодинамика 2.10. Термодинамические потенциалы F (A) - функция Гельмгольца - энергия Гельмгольца - изохорный
- 5. 2. Химическая термодинамика 2.10. Термодинамические потенциалы
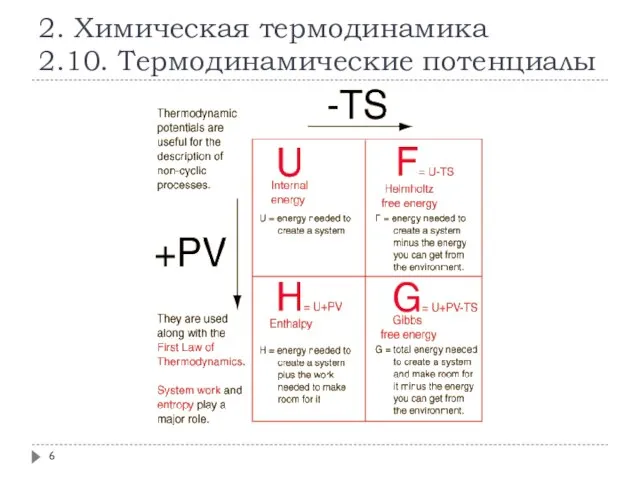
- 6. 2. Химическая термодинамика 2.10. Термодинамические потенциалы
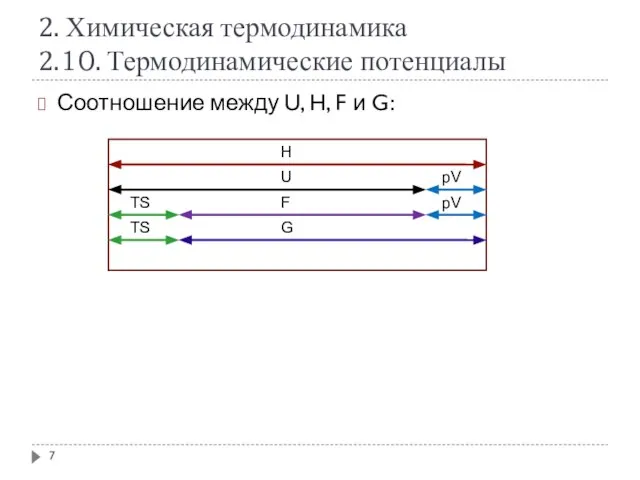
- 7. 2. Химическая термодинамика 2.10. Термодинамические потенциалы Соотношение между U, H, F и G: Н U F
- 8. 2. Химическая термодинамика 2.10. Термодинамические потенциалы F=U-TS при V=const Wmax=0 ΔF≤ 0
- 9. 2. Химическая термодинамика 2.10. Термодинамические потенциалы G=H-TS при Т=const при p,T = const и отсутствии других
- 10. 2. Химическая термодинамика 2.10. Термодинамические потенциалы Связь между ΔG и ΔF (ΔΑ)
- 11. 2. Химическая термодинамика 2.10. Термодинамические потенциалы Теплосодержание системы ΔH = ΔG + TΔS, ΔG = ΔH
- 12. 2. Химическая термодинамика 2.10. Термодинамические потенциалы Самопроизвольное протекание изохорно-изотермического процесса определяется энергией Гельмгольца (часть внутренней энергии,
- 13. 2. Химическая термодинамика 2.10. Термодинамические потенциалы Термодинамические потенциалы или характеристические функции – термодинамические функции, с помощью
- 14. 2. Химическая термодинамика 2.10. Термодинамические потенциалы Основное уравнение термодинамики Описывает зависимость термодинамических потенциалов от их естественных
- 15. 2. Химическая термодинамика 2.10. Термодинамические потенциалы Если в системе происходит химическая реакция или система открыта (т.е.
- 16. 2. Химическая термодинамика 2.10. Термодинамические потенциалы Химический потенциал характеризует приращение соответствующего термодинамического потенциала при изменении количества
- 17. 2. Химическая термодинамика 2.10. Термодинамические потенциалы Смысл термодинамических потенциалов: зная любой из четырех потенциалов как функцию
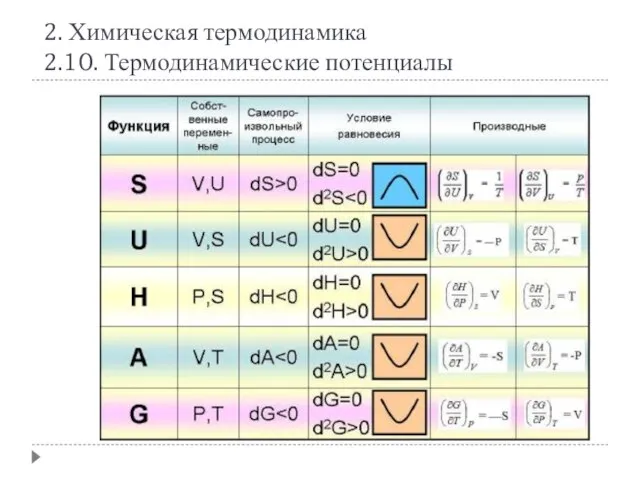
- 18. 2. Химическая термодинамика 2.10. Термодинамические потенциалы Любой термодинамический потенциал в необратимых самопроизвольных процессах, протекающих при постоянстве
- 19. 2. Химическая термодинамика 2.10. Термодинамические потенциалы
- 20. 2. Химическая термодинамика 2.10. Термодинамические потенциалы
- 21. 2. Химическая термодинамика 2.10. Термодинамические потенциалы
- 22. 2. Химическая термодинамика 2.10. Термодинамические потенциалы
- 23. 2. Химическая термодинамика 2.10. Термодинамические потенциалы
- 26. 2. Химическая термодинамика 2.10. Термодинамические потенциалы В химических процессах одновременно изменяются энтальпия (энергетический запас системы) и
- 27. 2. Химическая термодинамика 2.10. Термодинамические потенциалы Стандартная энергия Гиббса образования (при р=1 бар и Т=298К) -
- 28. 2. Химическая термодинамика 2.10. Термодинамические потенциалы По определению энергия Гиббса Самопроизвольное протекание изобарно-изотермического процесса определяется двумя
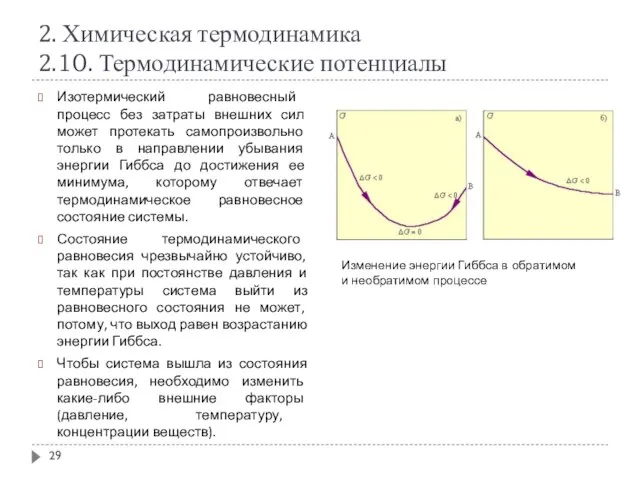
- 29. 2. Химическая термодинамика 2.10. Термодинамические потенциалы Изотермический равновесный процесс без затраты внешних сил может протекать самопроизвольно
- 30. 2. Химическая термодинамика 2.10. Термодинамические потенциалы
- 31. 2. Химическая термодинамика 2.10. Термодинамические потенциалы
- 32. 2. Химическая термодинамика 2.10. Термодинамические потенциалы Рассмотрим реакцию 2Н2(г)+О2(г)→2Н2О(ж) Изменение стандартной энергии Гиббса для неё равно
- 33. 2. Химическая термодинамика 2.10. Расчет ΔG в химических реакциях
- 34. 2. Химическая термодинамика 2.10. Расчет ΔG в химических реакциях
- 35. 2. Химическая термодинамика 2.10. Расчет ΔG в химических реакциях
- 36. 2. Химическая термодинамика 2.10. Расчет ΔG в химических реакциях
- 38. 2. Химическая термодинамика 2.11. Практические вопросы
- 39. 2. Химическая термодинамика 2.11. Практические вопросы
- 40. 2. Химическая термодинамика 2.11. Практические вопросы
- 41. 2. Химическая термодинамика 2.11. Практические вопросы
- 42. 2. Химическая термодинамика 2.11. Практические вопросы
- 43. 2. Химическая термодинамика 2.11. Практические вопросы
- 44. 2. Химическая термодинамика 2.11. Практические вопросы
- 45. 2. Химическая термодинамика 2.11. Практические вопросы
- 46. 2. Химическая термодинамика 2.11. Практические вопросы
- 47. 2. Химическая термодинамика 2.11. Практические вопросы
- 49. Скачать презентацию









































 Plexiglas. Органическое стекло
Plexiglas. Органическое стекло Без золота прожить можно, без соли нельзя
Без золота прожить можно, без соли нельзя Основы химической кинетики
Основы химической кинетики Флэшмоб: Лаборатория на кухне
Флэшмоб: Лаборатория на кухне Алкены. Роль алкенов в жизни человека
Алкены. Роль алкенов в жизни человека Водородные соединения неметаллов
Водородные соединения неметаллов Химиялық қоспалар
Химиялық қоспалар Терпеноиды. Эфирные масла
Терпеноиды. Эфирные масла Нітрогеновмісні сполуки
Нітрогеновмісні сполуки Основные законы и понятия химии. Основные классы неорганических соединений. Химический эквивалент. Закон эквивалентов
Основные законы и понятия химии. Основные классы неорганических соединений. Химический эквивалент. Закон эквивалентов Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия
Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия Оксиды азота
Оксиды азота Гибридизация
Гибридизация Презентация на тему Классификация углеводов
Презентация на тему Классификация углеводов  Ионные двигатели
Ионные двигатели План выполнения домашней работы по теме Алкадиены
План выполнения домашней работы по теме Алкадиены Презентация на тему Полимеры
Презентация на тему Полимеры  Азот. Аммиак. Соли аммония (1)
Азот. Аммиак. Соли аммония (1) Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака
Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака Алканы: строение, номенклатура, изомерия, физические свойства
Алканы: строение, номенклатура, изомерия, физические свойства Соединения алифатического ряда
Соединения алифатического ряда Нуклеинови киселини
Нуклеинови киселини Применение личностно-ориентированного подхода в обучении химии
Применение личностно-ориентированного подхода в обучении химии 20141013_dragotsennye_kamni_yuzhnogo_urala
20141013_dragotsennye_kamni_yuzhnogo_urala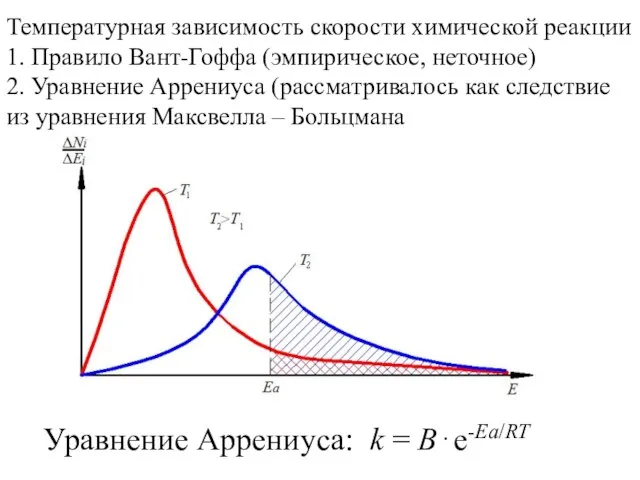 Температурная зависимость скорости химической реакции
Температурная зависимость скорости химической реакции Выращивание кристаллов медного купороса с использованием воды различной степени очистки
Выращивание кристаллов медного купороса с использованием воды различной степени очистки Коррозия металлов
Коррозия металлов Комплексонометрическое титрование. 5 лекция. Часть 2
Комплексонометрическое титрование. 5 лекция. Часть 2