Слайд 2Цели и задачи
Повторить строение атома и аллотропию на примере углерода.
Рассмотреть строение, сравнение

свойств и применение алмаза и графита.
Дать понятие об аморфном углероде и его сортах;
Познакомить с явлением адсорбции и его практическом значении.
Разобрать химические свойства углерода
Слайд 4Аллотропия
Аллотропия- явление существования в виде 2-х или нескольких простых веществ, различных по

строению и свойствам
Причины: для углерода – различное строение кристаллических решеток
Слайд 5Алмаз
Алмаз - прозрачное, бесцветное вещество с сильной лучепреломляемостью. Обладает твердостью, превосходящей твердость

всех известных в природе веществ. Химически очень устойчивое вещество.
Слайд 6Большая импера- Звезда ордена
торская корона Св. Андрея Первозванного

Слайд 7Графит
Графит- вещество серо – стального цвета, мягок, жирен на ощупь. Является хорошим

проводником электричества. Имеет слоистую структуру.
Слайд 9Аморфный углерод
Сорта:
1. Сажа – используется для изготовления типографской краски, картриджей, резины, косметической

туши и т. д.
2. Кокс – в доменных печах при выплавке чугуна.
3. Древесный уголь – в качестве топлива, при выплавке цветных металлов, очистки от примесей.
Слайд 10Адсорбция
Адсорбция – поглощение газообразных или растворенных веществ поверхностью твердого вещества.
Обусловлена пористостью угля
Обратный

процесс – десорбция
Применяется для очистки от примесей, в медицине, для защиты дыхательных путей
Слайд 11Химические свойства
C0
AI + C C + O2
H2 + C

C + F2
C + ZnO
+4ē
окислитель
восстанавливается
- 4ē
восстановитель
окисляется
AI4C3
CH4
CO2
CF4
2
3
2
4
2
2
Zn + CO2










 Основания. Получение оснований
Основания. Получение оснований Гидролиз солей
Гидролиз солей Блок колонн на установке замедленного коксования производительностью 730000 тонн/год гудрона (поз.к-1, кх-1)
Блок колонн на установке замедленного коксования производительностью 730000 тонн/год гудрона (поз.к-1, кх-1) Вывод и обсуждение
Вывод и обсуждение Графический диктант. Азот и Аммиак
Графический диктант. Азот и Аммиак Комплексные соединения
Комплексные соединения Чистые вещества и смеси, их разделение
Чистые вещества и смеси, их разделение Л1.4. Диаграмма железо-углерод
Л1.4. Диаграмма железо-углерод Презентация на тему Серная кислота (9 класс)
Презентация на тему Серная кислота (9 класс)  Организация самостоятельной работы на уроках химии 8 класса с использованием электронного учебника
Организация самостоятельной работы на уроках химии 8 класса с использованием электронного учебника Материаловедение. Полимерные материалы
Материаловедение. Полимерные материалы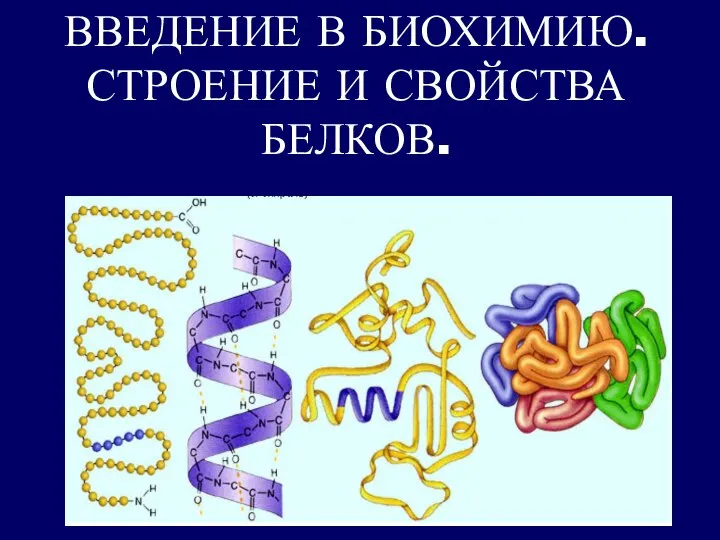 Введение в биохимию. Строение и свойства белков
Введение в биохимию. Строение и свойства белков Анилин - представитель ароматических аминов
Анилин - представитель ароматических аминов Полиамидное волокно-энант
Полиамидное волокно-энант Понятие Эффективность. Принцип Ле-Шателье
Понятие Эффективность. Принцип Ле-Шателье Круговорот азота в природе
Круговорот азота в природе Аминокислоты. Белки. Лекция 2
Аминокислоты. Белки. Лекция 2 Химический анализ
Химический анализ Спирты
Спирты Химические свойства бензола. Получение, применение. Учитель биологии-химии МОУ «СОШ р.п. Озинки» Хорова Людмила Владимировна
Химические свойства бензола. Получение, применение. Учитель биологии-химии МОУ «СОШ р.п. Озинки» Хорова Людмила Владимировна Хроматография
Хроматография Ogļūdeņražu karboksilatvasinājumi
Ogļūdeņražu karboksilatvasinājumi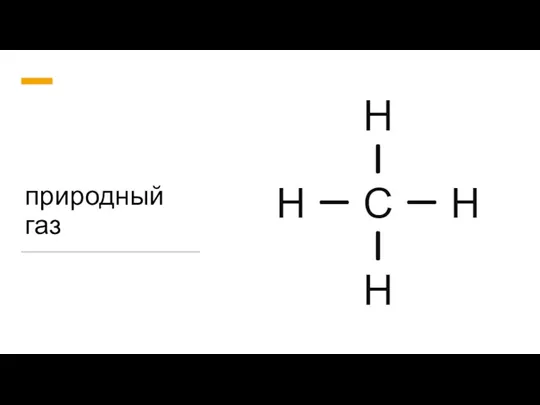 Природный газ
Природный газ Понятие о сплавах и методах их получения
Понятие о сплавах и методах их получения Биологическое окисление
Биологическое окисление Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость
Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость Материаловедение. Технология конструкционных материалов. Диаграмма состояния Fe-Fe3C
Материаловедение. Технология конструкционных материалов. Диаграмма состояния Fe-Fe3C Органическая химия. Теория строения органических веществ
Органическая химия. Теория строения органических веществ