Содержание
- 2. Вода является растворителем для многих твердых, жидких и газообразных веществ. Со многими веществами она образует растворы.
- 3. Растворами называются однородные системы, состоящие из молекул растворителя и растворенного вещества, между которыми происходят физические и
- 4. Растворимость веществ в воде. Не все вещества одинаково хорошо растворяются в воде. Чтобы сравнить насколько одно
- 5. Растворимость-это отношение массы вещества, образующего насыщенный раствор при данной температуре, к объему растворителя. Единицы измерения растворимости-
- 6. Раствор, в котором данное вещество при данной температуре больше уже не растворяется, называется насыщенным, а раствор,
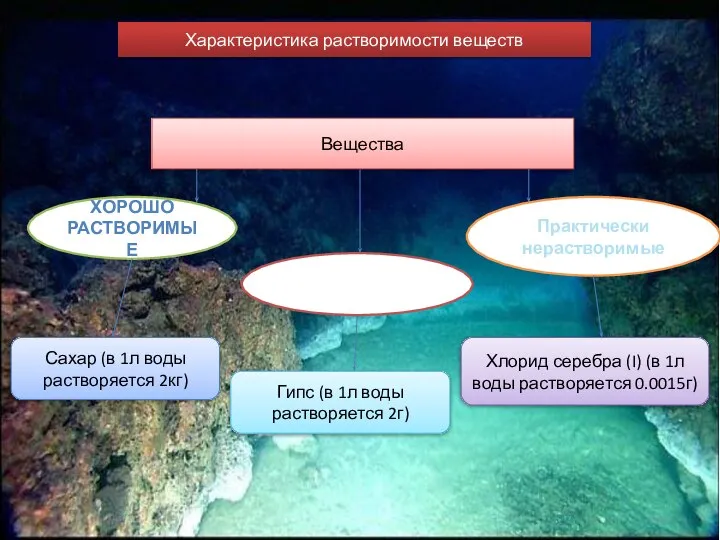
- 7. Если в 100г воды при комнатной температуре растворяется более 10г вещества, то оно называется хорошо растворимым
- 8. Если в 100г воды при комнатной температуре растворяется менее 1г вещества, то оно называется малорастворимым и
- 9. Если в 100г воды при комнатной температуре растворяется менее 0,01г вещества, то оно называется нерастворимым и
- 10. Вещества Характеристика растворимости веществ ХОРОШО РАСТВОРИМЫЕ Малорастворимые Практически нерастворимые Сахар (в 1л воды растворяется 2кг) Гипс
- 11. Растворимость большинства твердых веществ уменьшается с понижением температуры. Если горячий насыщенный раствор охладить, то некоторые твердые
- 12. Некоторые твердые вещества при понижении температуры не выделяются в виде кристаллов, а образуют перенасыщенные растворы.
- 13. Растворимость жидкостей и газов Жидкости и газы также могут растворяться в воде. Они, как и твердые
- 14. Многие газы, например водород, аргон, неон, очень плохо растворяются в воде, а хлороводород, аммиак, наоборот хорошо.
- 15. Вода- химически активное вещество. При растворении в воде газов, жидкостей и твердых веществ образуются однородные прозрачные
- 16. Вода- универсальный растворитель. Растворы- однородные системы, состоящие из системы молекул растворителя и растворного вещества
- 18. Скачать презентацию














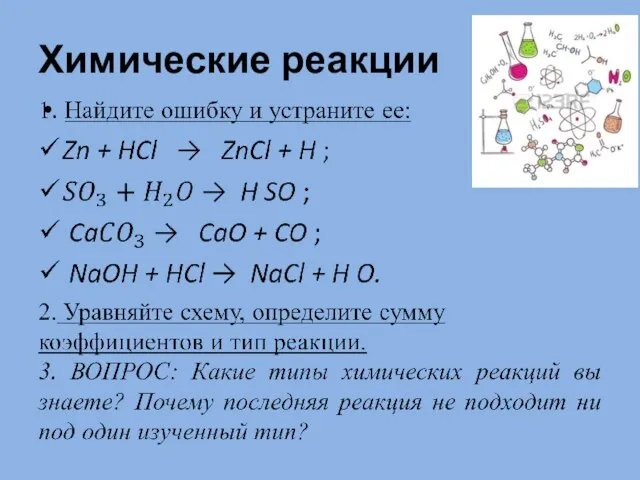 Химические реакции
Химические реакции Минеральные кислоты. Взаимодействие с простыми веществами
Минеральные кислоты. Взаимодействие с простыми веществами Основания. Щелочи – растворимые основания
Основания. Щелочи – растворимые основания Презентация на тему Сведения о воде
Презентация на тему Сведения о воде  Аттестационная работа. Музей минералов и горных пород
Аттестационная работа. Музей минералов и горных пород Презентация на тему Карбоновые кислоты и их производные
Презентация на тему Карбоновые кислоты и их производные  Ферменты
Ферменты Жизнь и деятельность Д.И.Менделеева «Если не будешь знать имен, то умрет и познание вещей» К.Линей. Автор: Ватитова А.А. МОУ Еласов
Жизнь и деятельность Д.И.Менделеева «Если не будешь знать имен, то умрет и познание вещей» К.Линей. Автор: Ватитова А.А. МОУ Еласов Агрегатные состояния воды
Агрегатные состояния воды Белки
Белки Молярный объем газов. Закон Авогадро
Молярный объем газов. Закон Авогадро Стехиометрические законы химии
Стехиометрические законы химии Кетоны. Формулы кетонов
Кетоны. Формулы кетонов Основания: определение, классификация, химические свойства
Основания: определение, классификация, химические свойства Металлическая химическая связь
Металлическая химическая связь Удивительные приборы: Термометр
Удивительные приборы: Термометр Дисперсные системы
Дисперсные системы Окислительные свойства концентрированной серной кислоты
Окислительные свойства концентрированной серной кислоты Щелочноземельные металлы
Щелочноземельные металлы Маска откройся
Маска откройся Навчальний проект Дослідження зміни концентрації CO2 у класній кімнаті під час занять
Навчальний проект Дослідження зміни концентрації CO2 у класній кімнаті під час занять Кристаллическое состояние полимеров
Кристаллическое состояние полимеров Первоначальные химические понятия
Первоначальные химические понятия Склероглюкан
Склероглюкан Гальванические элементы
Гальванические элементы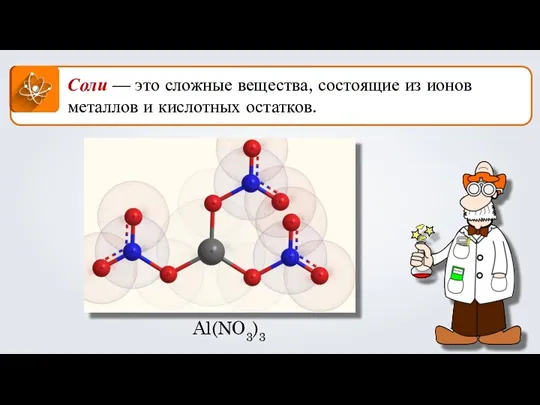 Соли. Формула соли
Соли. Формула соли Азотная кислота
Азотная кислота Строение атома
Строение атома