Содержание
- 2. Если поместить медную монету в раствор сульфата цинка, добавить туда цинковых гранул и полученную смесь нагреть,
- 3. Цель: Объяснить наблюдаемое явление оцинкования и выявить факторы от которых оно зависит. Задачи: Выявить факторы, влияющие
- 4. Ограничения Покрытие цинком в объяснении процесса будем считать сплошным [1] Мы покрываем цинком монокристалл меди. Медная
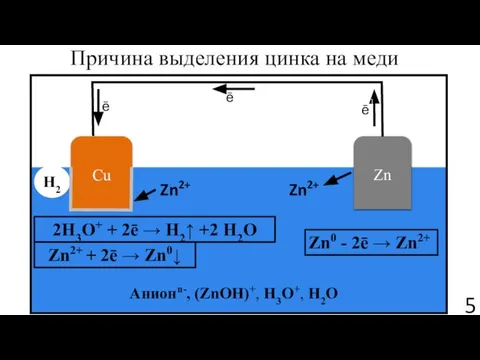
- 5. Zn2+ Анионn-, (ZnOH)+, H3O+, H2O Zn2+ Zn ē ē Cu ē H2 Причина выделения цинка на
- 6. ϕ(Zn аморфный) Вывод: процесс не идет Zn
- 7. Противоречие:
- 8. Максимальная толщина ЦИНКОВОГО покрытия равна 0!
- 9. Диффузионная модель
- 10. Факторы, влияющие на выделение цинка ϑпроцесса = f(C Zn2+ в р-ре) ϑпроцесса = f(Т), где Т
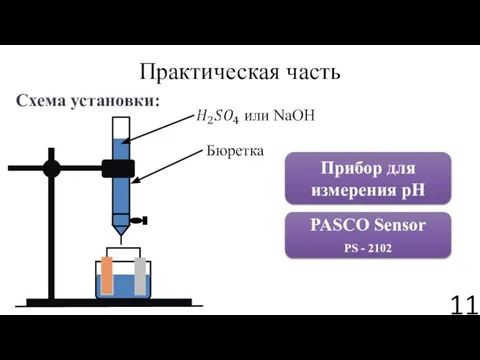
- 11. Практическая часть Схема установки: Бюретка Прибор для измерения pH PASCO Sensor PS - 2102
- 13. Возможность процесса = f(pH) Методика опыта
- 14. Возможность процесса = f(pH) Первый эксперимент Результат: Процесс идет.
- 15. Возможность процесса = f(pH) Второй эксперимент Результат: Процесс идет.
- 16. Возможность процесса = f(pH) Третий эксперимент Результат: Процесс идет.
- 17. Покрытие меди кадмием методом, предложенным в задаче Cd/Cu
- 18. Покрытие меди кадмием методом, предложенным в задаче Cd/Cu Результат:
- 19. Покрытие меди свинцом методом, предложенным в задаче Pb/Cu
- 20. Покрытие меди свинцом методом, предложенным в задаче Pb/Cu Результат: Pb
- 21. Цинк на железе не выделяется вообще! ΔϕFe/Zn 2. Fe0 + H+ (в результате гидролиза соли) →Fe2+
- 22. Максимальная толщина цинкового покрытия на меди = 0 Максимальная толщина цинкового покрытия на железном гвозде =
- 23. Литература А.А. Караванова, М.М. Криштал, А.А. Еремичев, И.С. Ясников, В.В. Окулов – Механизм образования слоистой структуры
- 24. Покрытие серебра медью методом, предложенным в задаче Cu/Ag
- 25. Покрытие серебра медью методом, предложенным в задаче Результат: Cu/Ag
- 26. 2ZnSO4 + 2H2O ↔ (ZnOH)2SO4 + H2SO4 Zn2+ + H2O ↔ ZnOH+ + H+ 1 ступень
- 27. Практическая часть
- 28. Практическая часть
- 29. Практическая часть
- 30. Практическая часть
- 31. Практическая часть Результаты Начальный pH=2,7 После добавления кислоты до pH=1,4 После добавления щелочи до pH=10,3 Цинковое
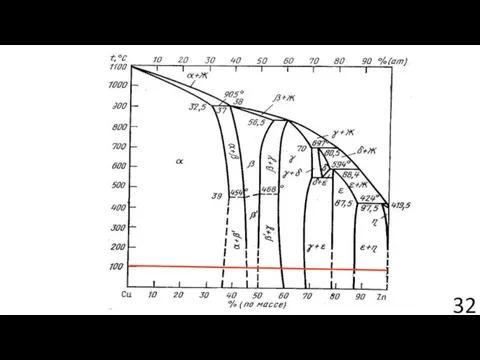
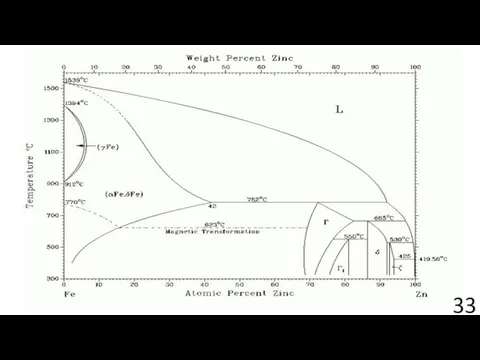
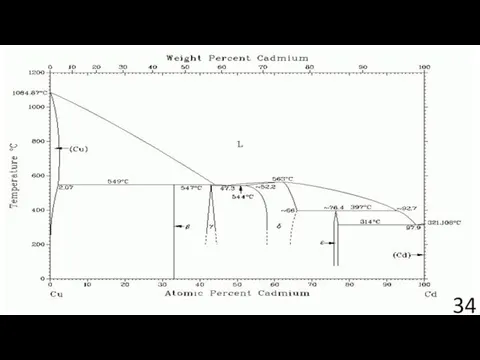
- 35. Диффузионная модель ДИФФУЗИЯ НА ГРАНИЦЕ “ПЛЕНКА–ПОДЛОЖКА” ПРИ ЭЛЕКТРОКРИСТАЛЛИЗАЦИИ ЦИНКА НА МЕДНОЙ ПОДЛОЖКЕ Э. Ф. Штапенко, В.
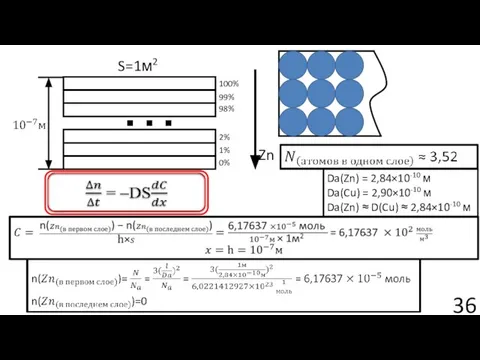
- 36. … 100% 99% 98% 2% 1% 0% Zn S=1м2 Da(Zn) = 2,84×10-10 м Da(Cu) = 2,90×10-10
- 38. Скачать презентацию


![Ограничения Покрытие цинком в объяснении процесса будем считать сплошным [1] Мы покрываем](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/881943/slide-3.jpg)


























 Масляная кислота
Масляная кислота Презентация на тему Самородки 9 класс
Презентация на тему Самородки 9 класс  Классификация реакций. Таблица
Классификация реакций. Таблица Химия, химия, химия!
Химия, химия, химия! Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов
Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов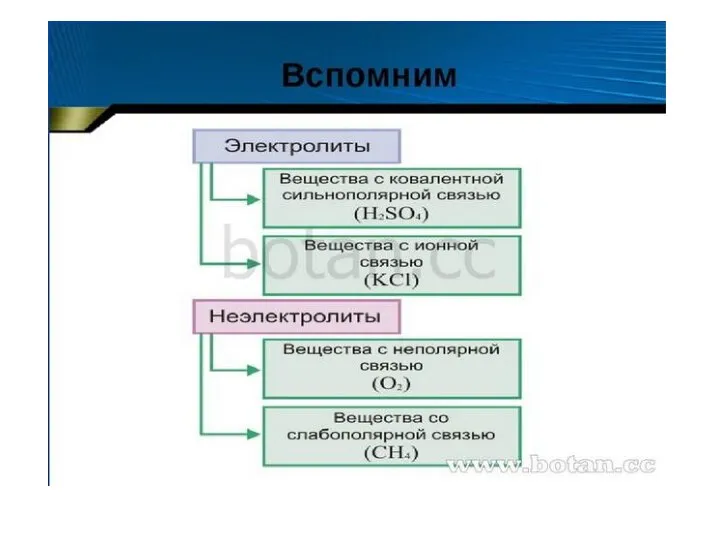 Диссоциация кислот, щелочей солей
Диссоциация кислот, щелочей солей Кислород O2
Кислород O2 Добыча золота в России По теме «Внешние эффекты и права собственности»
Добыча золота в России По теме «Внешние эффекты и права собственности» Основания. Классификация, состав и номенклатура оснований
Основания. Классификация, состав и номенклатура оснований Медь и ее сплавы
Медь и ее сплавы Особенности структуры сплава FeCu1Si16B6 на нанометровом и морфологическом уровнях
Особенности структуры сплава FeCu1Si16B6 на нанометровом и морфологическом уровнях Алкены
Алкены минералы_4_блеск
минералы_4_блеск Опасность вещества поливинилхлорида
Опасность вещества поливинилхлорида Карбоновые кислоты
Карбоновые кислоты Степень окисления. Электроотрицательность. Формулы бинарных соединений
Степень окисления. Электроотрицательность. Формулы бинарных соединений ФБОУ- Раздольненская средняя общеобразовательная школа №19 Новосибирского района Новосибирской области
ФБОУ- Раздольненская средняя общеобразовательная школа №19 Новосибирского района Новосибирской области Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Вода. Интеллектуальная игра
Вода. Интеллектуальная игра Химическая промышленность России входит в авангардную тройку
Химическая промышленность России входит в авангардную тройку Презентация на тему Коррозия металлов (11 класс)
Презентация на тему Коррозия металлов (11 класс)  Закон сохранения массы и энергии
Закон сохранения массы и энергии Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Химия и производство
Химия и производство Презентация на тему Хлор - физиологическая и патологическая роль в организме человека
Презентация на тему Хлор - физиологическая и патологическая роль в организме человека  Серебро
Серебро Ароматические полиамиды (арамиды)
Ароматические полиамиды (арамиды) Кристаллические решетки
Кристаллические решетки