Содержание
- 2. Задачи химической кинетики Все задачи химической кинетики разделяются на прямые и обратные. Прямая задача химической кинетики
- 3. Методы определения порядка реакции (обратная задача) Интегральные (аналитические и графические) - Метод подбора (подстановки)уравнений - Метод
- 5. Метод подбора уравнений Графический метод Недостаток – работает только для целых порядков n
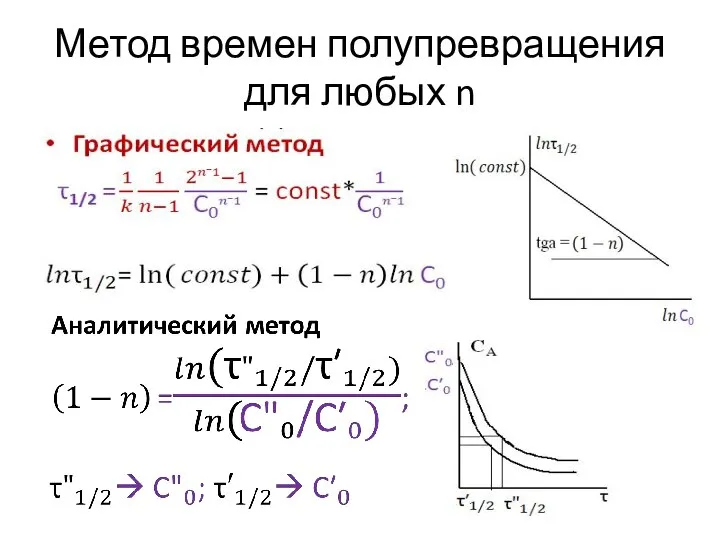
- 6. Метод времен полупревращения для любых n
- 7. Метод избыточных концентраций
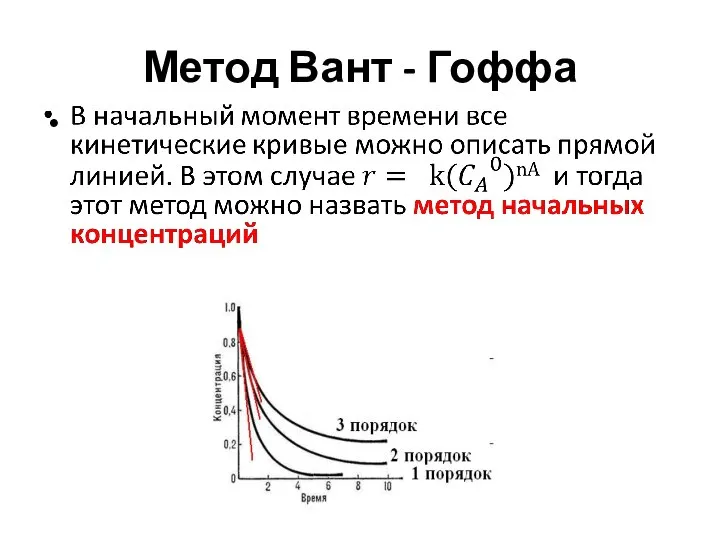
- 8. Метод Вант – Гоффа Дифференциальный метод
- 9. Метод Вант - Гоффа
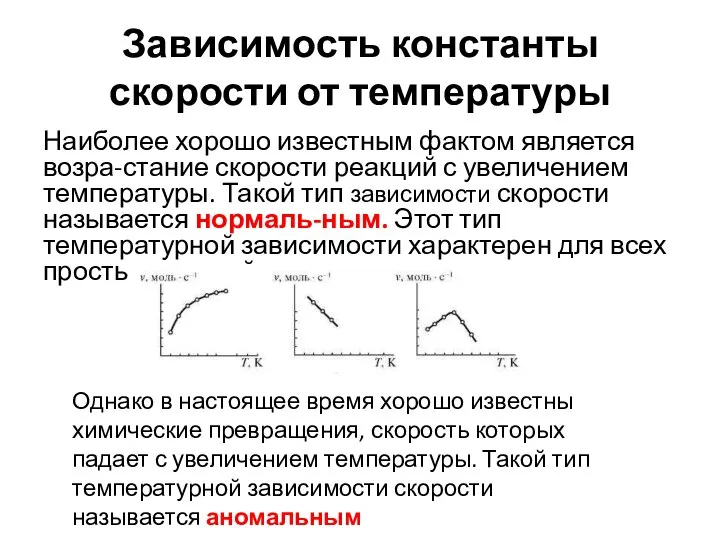
- 10. Зависимость константы скорости от температуры Наиболее хорошо известным фактом является возра-стание скорости реакций с увеличением температуры.
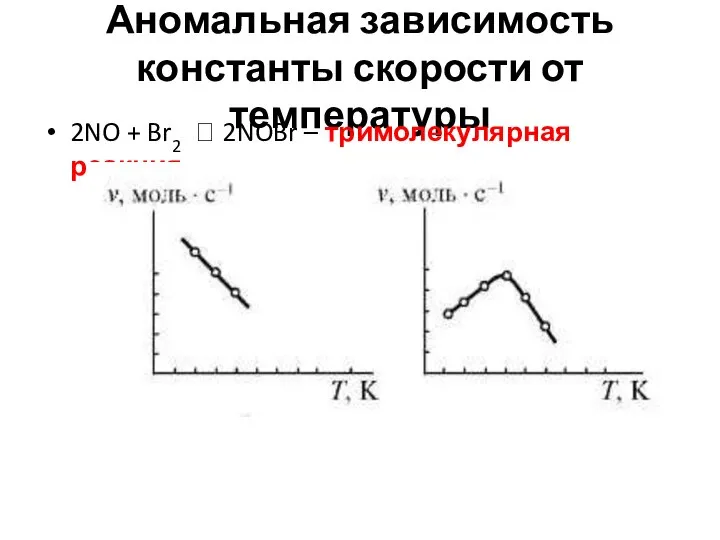
- 11. Аномальная зависимость константы скорости от температуры 2NO + Br2 ? 2NOBr – тримолекулярная реакция
- 12. Ферментативных реакции Особый интерес представляет зависимость от температуры скорости ферментативных реакций. Например, при разложении Н2О2 в
- 13. Правило Вант - Гоффа Зависимость скорости простой гомогенной реакции от температуры может быть выражена правилом Вант-Гоффа:
- 14. Уравнение Аррениуса
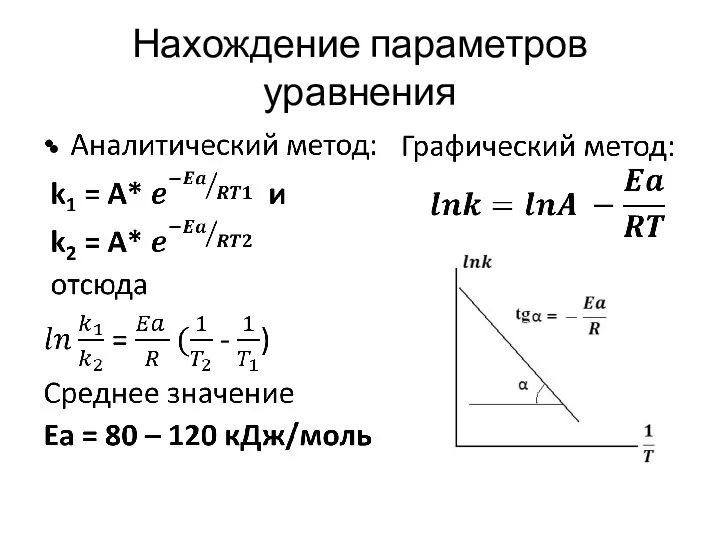
- 15. Нахождение параметров уравнения
- 16. Cостояние реагирующей системы
- 17. Открытые системы Системы, в которых имеет место материальный обмен с окружающей средой, называются открытыми системами. Большинство
- 18. Статический реактор
- 19. Реактор идеального вытеснения Реактор идеального вытеснения (РИВ) представляет собой трубчатый аппарат, в котором отношение длины трубы
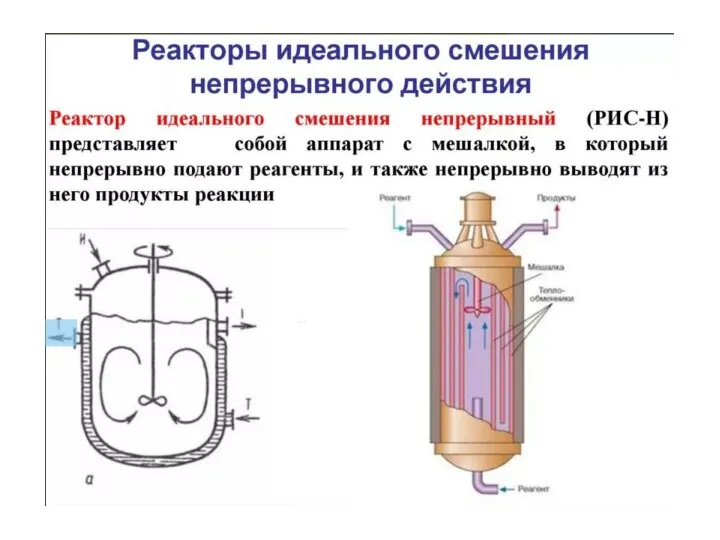
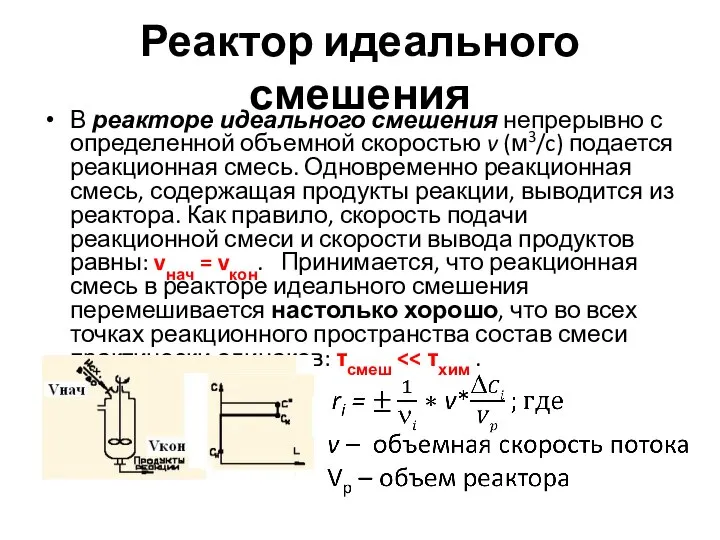
- 21. Реактор идеального смешения В реакторе идеального смешения непрерывно с определенной объемной скоростью v (м3/c) подается реакционная
- 22. Cложные реакции
- 23. Пример Длительное время считалось, что реакция, отвечающая уравнению: H2 + I2 → 2HI является простой бимолекулярной
- 24. Пример сложной реакции Механизм данной реакции: I2 → 2I ; r1 = k1*CI2 2I → I2;
- 25. Принцип независимости
- 26. Пример сложной реакции Механизм данной реакции: I2 → 2I ; r1 = k1*CI2 2I → I2;
- 27. Пример сложной реакции Механизм данной реакции: I2 → 2I r1 = k1*CI2 2I → I2 r-1
- 28. Проверка WН = +r2 -2r3 +2r-3 = k2*CI*СН2 -2k3*C2Н +2k-3*CН2 WН2 = -r2 + r3 -
- 29. Типы сложных реакций Простейшими типами сложных реакций являются: - Обратимые реакции; - Параллельные реакции; - Последовательные
- 30. Ну что начнем ?
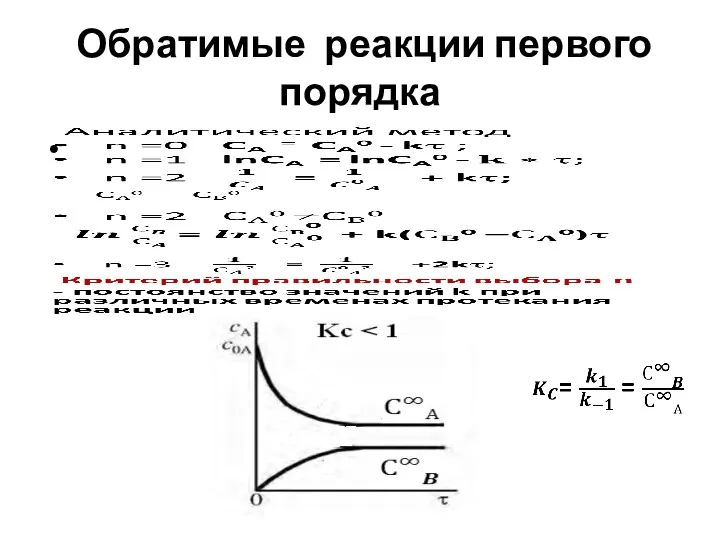
- 31. Обратимые реакции первого порядка
- 32. Обратимые реакции
- 33. Вывод уравнения
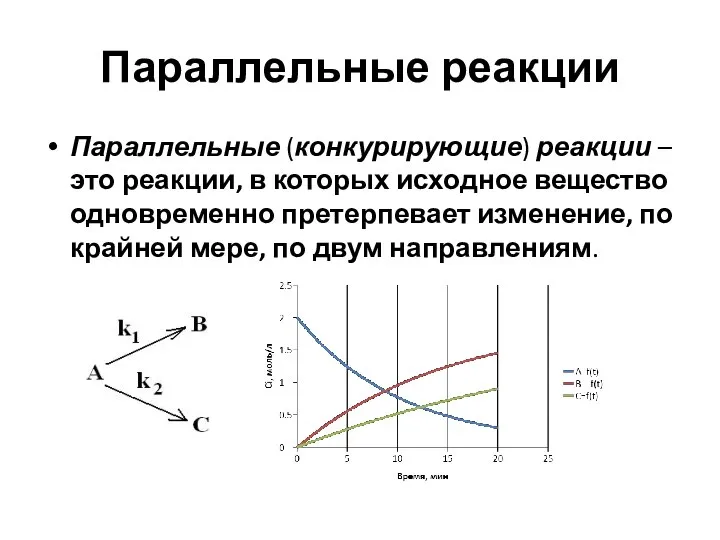
- 35. Параллельные реакции Параллельные (конкурирующие) реакции – это реакции, в которых исходное вещество одновременно претерпевает изменение, по
- 36. Вывод уравнения
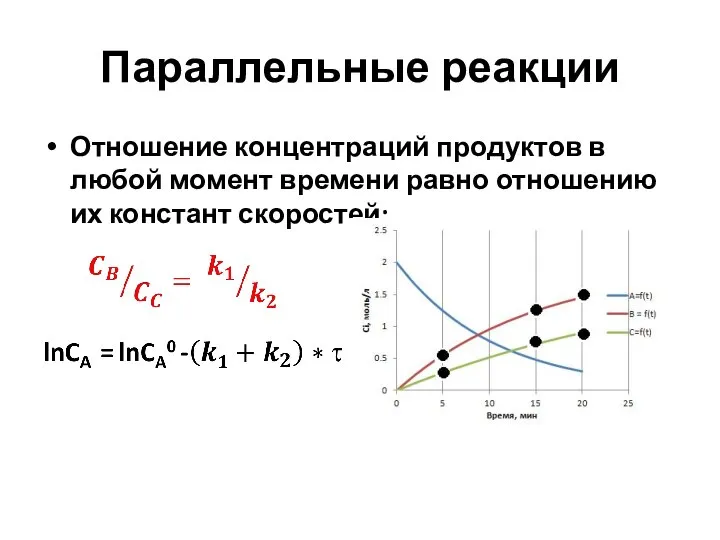
- 37. Параллельные реакции Отношение концентраций продуктов в любой момент времени равно отношению их констант скоростей:
- 38. Селективность процесса
- 39. Примеры Нитрование толуола: σорто = 0,333 σмета = 0,178 σпара = 0,489
- 40. Последовательные реакции
- 41. Вывод уравнения
- 42. Вывод уравнения
- 43. Итоги
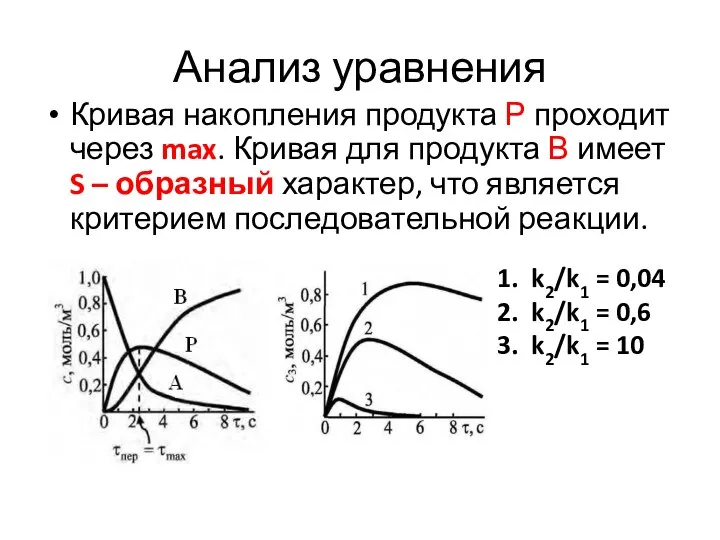
- 44. Анализ уравнения Кривая накопления продукта Р проходит через max. Кривая для продукта В имеет S –
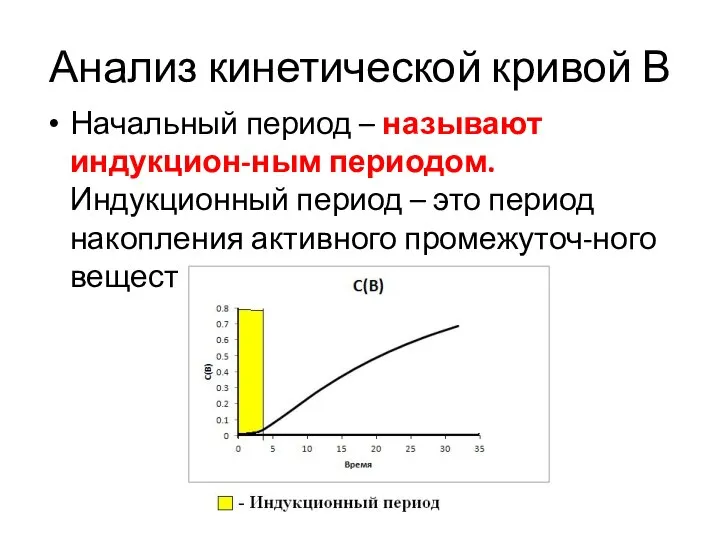
- 45. Анализ кинетической кривой В Начальный период – называют индукцион-ным периодом. Индукционный период – это период накопления
- 46. Анализ точки max
- 47. Выводы
- 48. Метод квазистационарных концентраций (МКСК)
- 49. Приближенные методы описания кинетики сложных реакций Метод квазистационарных концентраций (МКСК) Метод квазиравновесных концентраций – (МКРК) Метод
- 50. Метод квазистационарных концентраций (МКСК) МКСК позволяет заметить часть дифференциаль-ных уравнений для скорости на алгебраические ур-ния. Условия
- 51. Девушки не забутьте поздравить с праздником своих мальчиков
- 53. Скачать презентацию






































 Соли. Определение, состав, классификация, физические свойства, применение
Соли. Определение, состав, классификация, физические свойства, применение Карбоновые кислоты
Карбоновые кислоты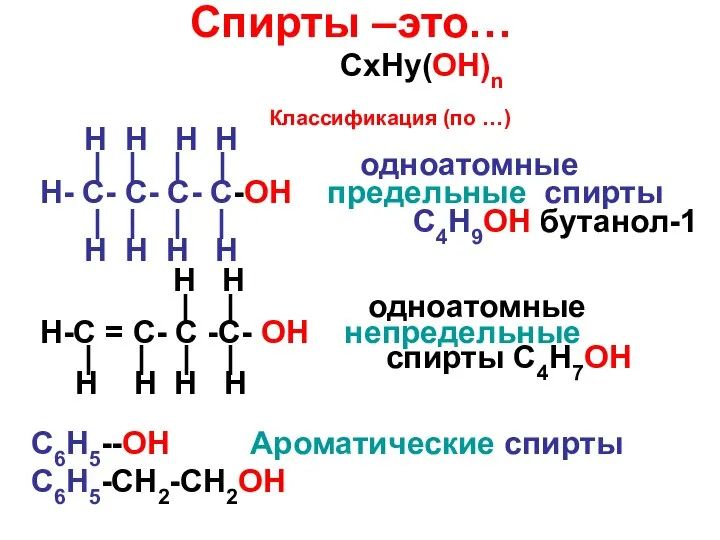 Спирты –это…
Спирты –это… Обобщение знаний по курсу органической химии
Обобщение знаний по курсу органической химии Коррозия металлов
Коррозия металлов Синтетические волокна
Синтетические волокна Простые вещества – неметаллы
Простые вещества – неметаллы Химическое равновесие. Экзаменационные вопросы
Химическое равновесие. Экзаменационные вопросы Язык химии. Знаки химических элементов
Язык химии. Знаки химических элементов Неорганические вещества клетки для дистанта (2)
Неорганические вещества клетки для дистанта (2) Презентация на тему Железо 9 класс
Презентация на тему Железо 9 класс  Chemické reakcie
Chemické reakcie Степени окисления и формулы веществ
Степени окисления и формулы веществ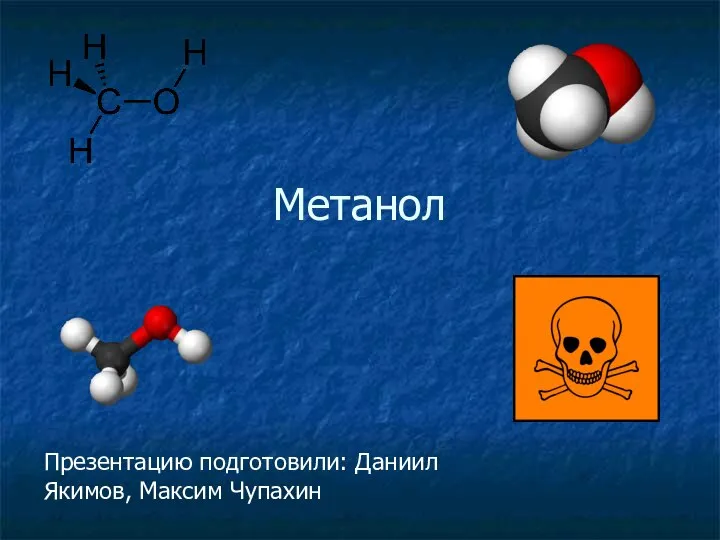 Метанол. Краткая характеристика
Метанол. Краткая характеристика Енергетика хімічних процесів
Енергетика хімічних процесів Синтез макромолекул
Синтез макромолекул Презентация на тему Влияние химических веществ на рост и развитие растений
Презентация на тему Влияние химических веществ на рост и развитие растений  Неорганические вещества клетки
Неорганические вещества клетки Тест: Азот
Тест: Азот Сходство химического состава клеток разных организмов как доказательство их родства
Сходство химического состава клеток разных организмов как доказательство их родства Презентация на тему Что такое белки?
Презентация на тему Что такое белки?  Карбоновые кислоты. Тест. 10 класс
Карбоновые кислоты. Тест. 10 класс Презентация на тему Химические средства гигиены и косметика
Презентация на тему Химические средства гигиены и косметика  Презентация на тему День Земли, Воды и Чистого воздуха
Презентация на тему День Земли, Воды и Чистого воздуха  Процесс образования неметаллических включений в стали
Процесс образования неметаллических включений в стали Практическая работа. Решение экспериментальных задач по неорганической химии с использованием виртуальной лаборатории
Практическая работа. Решение экспериментальных задач по неорганической химии с использованием виртуальной лаборатории Что объединяет вкус яблока, киви, садовой земляники?
Что объединяет вкус яблока, киви, садовой земляники? Бинарные соединения – оксиды и летучие водородные соединения. 8 класс
Бинарные соединения – оксиды и летучие водородные соединения. 8 класс