Содержание
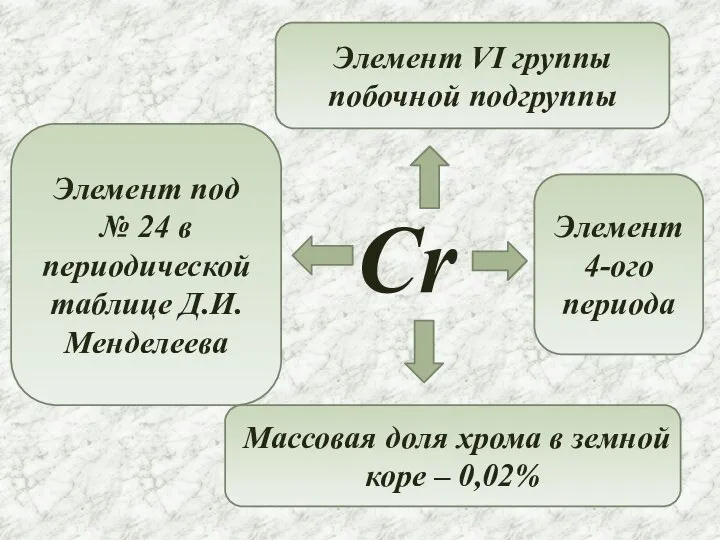
- 2. Cr Элемент под № 24 в периодической таблице Д.И.Менделеева Элемент VI группы побочной подгруппы Элемент 4-ого
- 3. Нахождение в природе Хромистый железняк FeO* Cr2O3 Хромит FeCr2O4 Крокоит PbCrO4
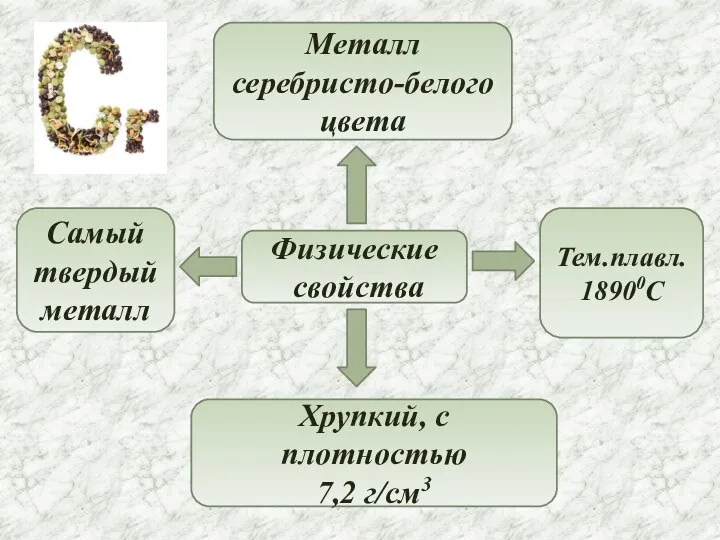
- 4. Физические свойства Металл серебристо-белого цвета Самый твердый металл Хрупкий, с плотностью 7,2 г/см3 Тем.плавл. 18900C
- 5. Химические свойства хрома 1.Реагирует с неметаллами(при нагревании) А)4Cr + 3O2 =2Cr2O3 Б)2Cr + N2 =2CrN В)2Cr
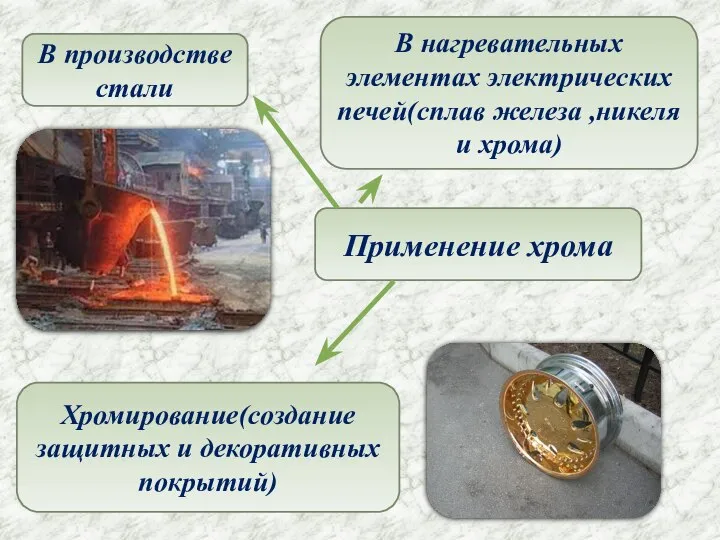
- 6. Применение хрома В производстве стали В нагревательных элементах электрических печей(сплав железа ,никеля и хрома) Хромирование(создание защитных
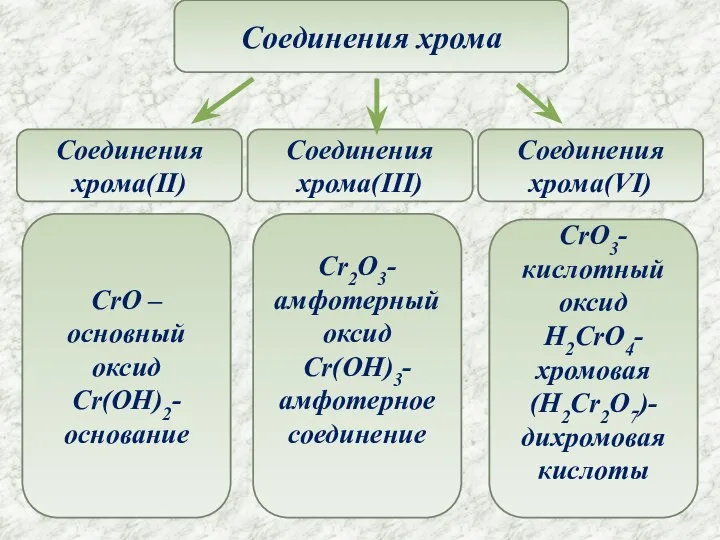
- 7. Соединения хрома Соединения хрома(II) Соединения хрома(III) Соединения хрома(VI) CrO –основный оксид Cr(OH)2- основание CrO3-кислотный оксид H2CrO4-хромовая
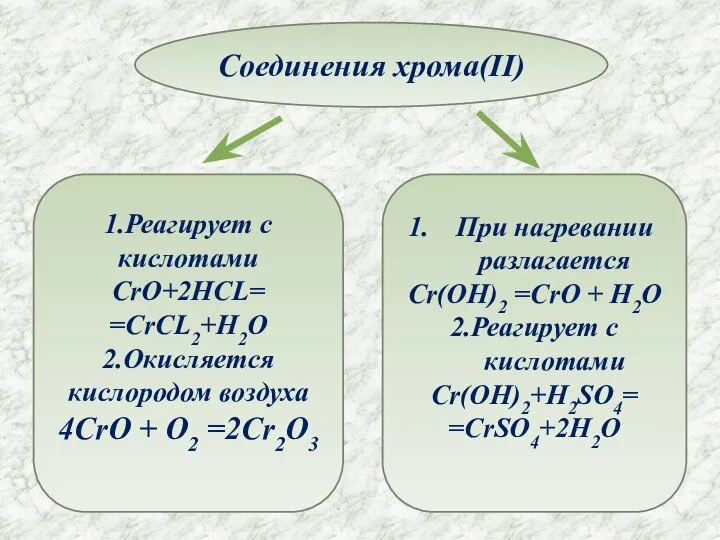
- 8. Соединения хрома(II) 1.Реагирует с кислотами CrO+2HCL= =CrCL2+H2O 2.Окисляется кислородом воздуха 4CrO + O2 =2Cr2O3 При нагревании
- 9. Соединения хрома(III) Cr2O3 –при обычных условиях не реагирует с растворами кислот и щелочей . Cr2O3 –реагирует
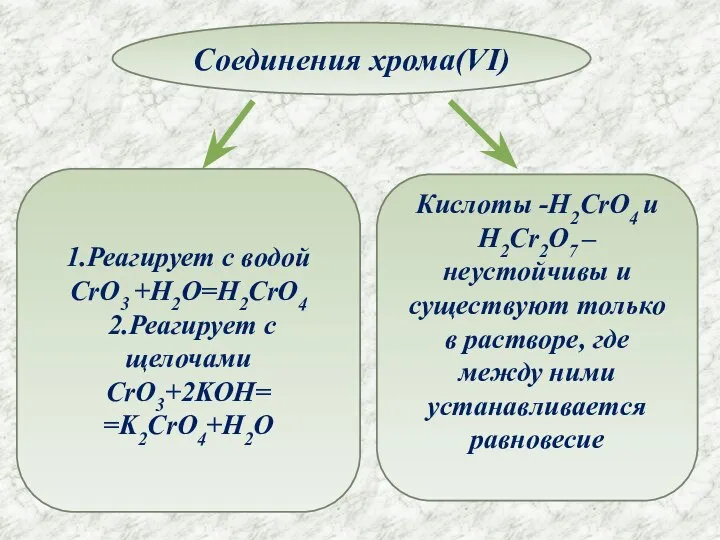
- 10. Соединения хрома(VI) 1.Реагирует с водой CrO3 +H2O=H2CrO4 2.Реагирует с щелочами CrO3+2KOH= =K2CrO4+H2O Кислоты -H2CrO4 и H2Cr2O7
- 11. Сульфат хрома и хромокалиевые квасцы используют для изготовления прочной хромовой кожи Соединения хрома применяют в качестве
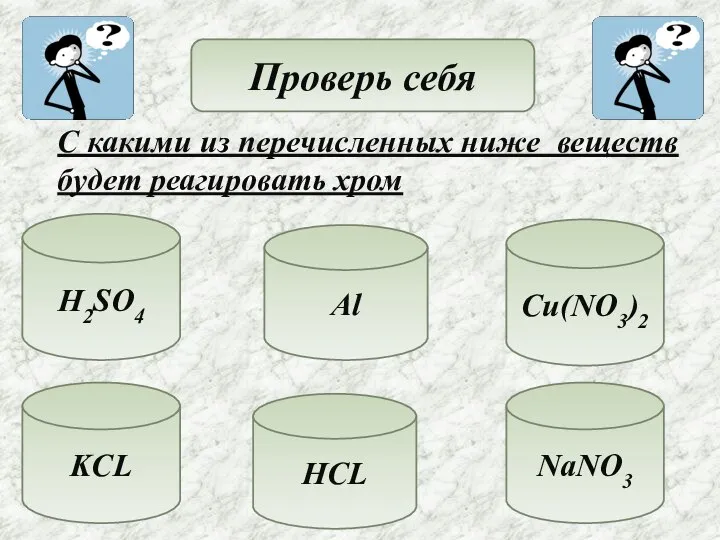
- 12. Проверь себя С какими из перечисленных ниже веществ будет реагировать хром H2SO4 Al KCL HCL NaNO3
- 14. Скачать презентацию




 Алкены
Алкены Типы кристаллических решеток
Типы кристаллических решеток Развитие познавательной активности творческих способностей и индивидуализация на уроках химии
Развитие познавательной активности творческих способностей и индивидуализация на уроках химии Алкены. Гомологический ряд алкенов. Изомерия алкенов
Алкены. Гомологический ряд алкенов. Изомерия алкенов Переваривание и всасывание жиров
Переваривание и всасывание жиров Воздух
Воздух Фосфолипиды. Глицерофосфолипиды. Сфингофосфолипиды. Гликолипиды
Фосфолипиды. Глицерофосфолипиды. Сфингофосфолипиды. Гликолипиды Химия вокруг нас. 10 класс
Химия вокруг нас. 10 класс Анализ углеводов в пищевых продуктах
Анализ углеводов в пищевых продуктах Полиморфизм и метастабильные состояния в однокомпонентных системах
Полиморфизм и метастабильные состояния в однокомпонентных системах Alkalické kovy
Alkalické kovy Электрохимические процессы
Электрохимические процессы Современные способы защиты ОТТ
Современные способы защиты ОТТ Периодическая система Д.И.Менделеева
Периодическая система Д.И.Менделеева Эфиры. Жиры
Эфиры. Жиры Основной государственный экзамен Химия 2021
Основной государственный экзамен Химия 2021 Презентация на тему Химия в быту
Презентация на тему Химия в быту  Презентация на тему СПИРТЫ (аканолы, алкоголи)
Презентация на тему СПИРТЫ (аканолы, алкоголи)  Винная кислота
Винная кислота Химическая связь в органических соединениях
Химическая связь в органических соединениях Лекция 6 Нарушения кислотнощелочного равновесия ацидозы, алкалозы
Лекция 6 Нарушения кислотнощелочного равновесия ацидозы, алкалозы Стереоизомерия
Стереоизомерия Вещество как система. Номенклатура неорганических веществ
Вещество как система. Номенклатура неорганических веществ Воздух и его свойства
Воздух и его свойства Полиметилсилсесквиоксаны. Современное состояние исследований
Полиметилсилсесквиоксаны. Современное состояние исследований Fosforan V wapnia Ca3(PO4)2
Fosforan V wapnia Ca3(PO4)2 Создание теплостойких эластомерных материалов на основе фторкаучуков
Создание теплостойких эластомерных материалов на основе фторкаучуков Ксилит. Получение
Ксилит. Получение