Содержание
- 2. Ст.ок. простых в-в = 0. Ст.ок. элементов в сложном веществе в большинстве случаев численно совпадает с
- 3. Определите степени окисления элементов по формулам: Н2SO4, Na2O, Cu, P2O5, CH4, CaCO3, Cl2O7, N2, Al2S3, HBrO3,
- 4. По изменению степеней окисления элементов, образующих вещества Окислительно- восстановительные реакции (ОВР) Окислительно-восстановительные реакции
- 5. Какие реакции являются ОВР, а какие не являются? 2KNO3→2KNO2 + O2 С + О2→СО2 CaO +
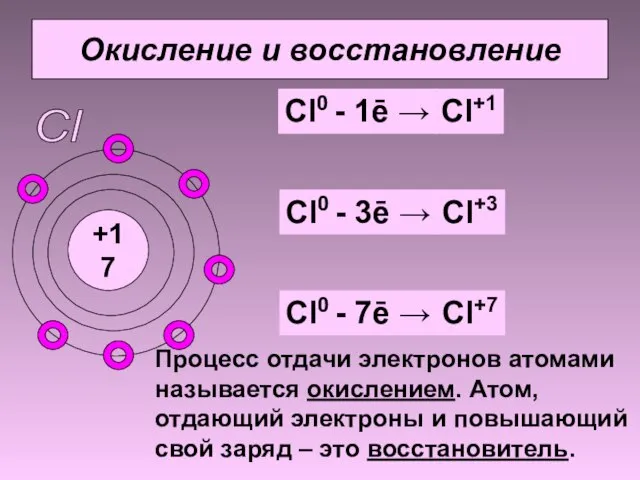
- 6. Окисление и восстановление +17 Cl Cl0 - 1ē → Cl+1 Cl0 - 3ē → Cl+3 Cl0
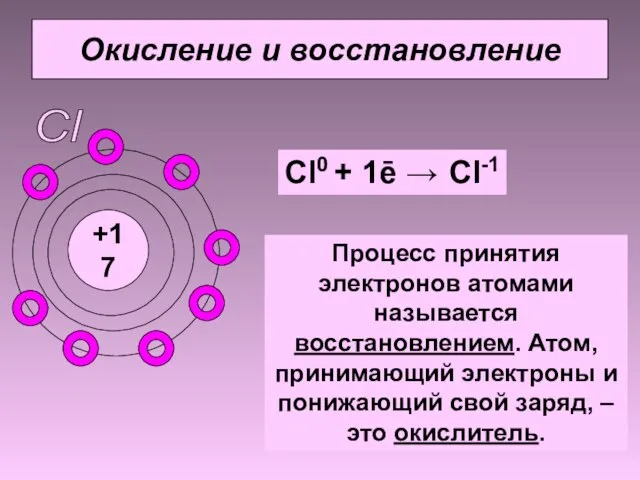
- 7. Окисление и восстановление Cl +17 Cl0 + 1ē → Cl-1 Процесс принятия электронов атомами называется восстановлением.
- 8. Определите процесс, роль элемента и количество отданных или принятых атомом электронов C0→C+4 S+4→S-2 Cl+7→Cl-1 P-3→P+5 2N-3→N20
- 9. Расстановка коэффициентов в ОВР методом электронного баланса 1. Расставить степени окисления элементов. 2. Выписать элементы, изменившие
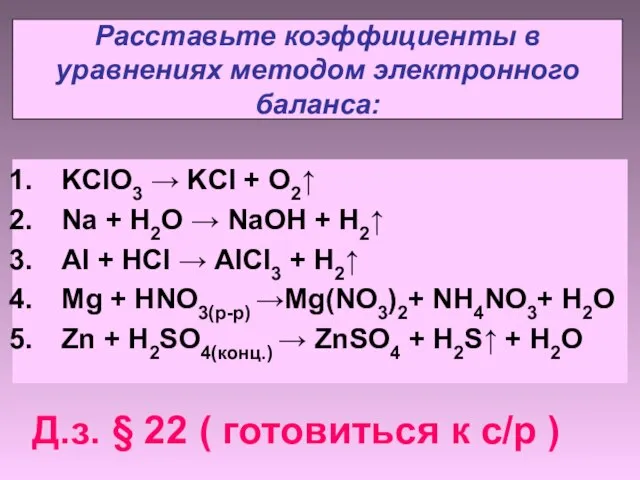
- 10. Расставьте коэффициенты в уравнениях методом электронного баланса: KClO3 → KCl + O2↑ Na + H2O →
- 12. Скачать презентацию





 Применение сверхкритических флюидных технологий в химии природных соединений
Применение сверхкритических флюидных технологий в химии природных соединений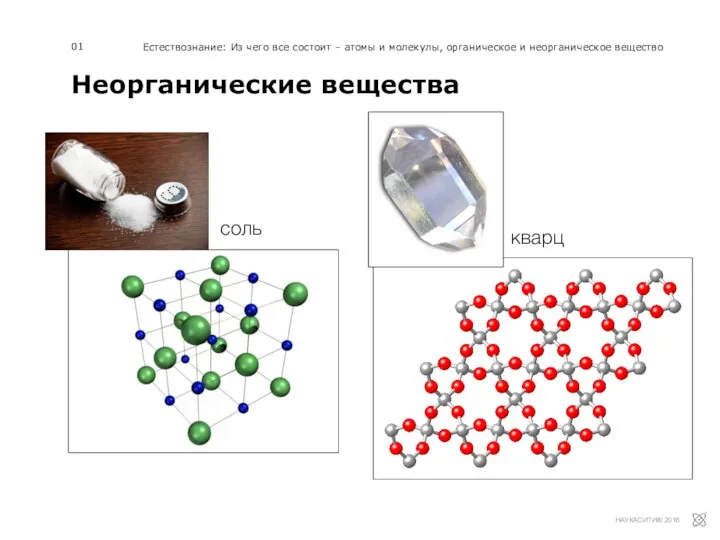 Неорганические вещества
Неорганические вещества Циклоалканы. Строение, изомерия, получение и свойства
Циклоалканы. Строение, изомерия, получение и свойства Классификация химических реакций
Классификация химических реакций Спирттің сақталуы туралы айтып беріңіз. Көмірқышқылының амидтік туындылары туралы айтып беріңіз
Спирттің сақталуы туралы айтып беріңіз. Көмірқышқылының амидтік туындылары туралы айтып беріңіз Экстракционное разделение радионуклидов
Экстракционное разделение радионуклидов Карбоновые кислоты
Карбоновые кислоты Презентация на тему Графен - материал будущего
Презентация на тему Графен - материал будущего  Электролитическая диссоциация. 8 класс
Электролитическая диссоциация. 8 класс Научный эксперимент в химической технологии
Научный эксперимент в химической технологии Анализ образцов колбасных изделий, образцов бытовой химии, напитков
Анализ образцов колбасных изделий, образцов бытовой химии, напитков Органическая химия
Органическая химия Застосування рідких кристалів
Застосування рідких кристалів Способы получения металлов
Способы получения металлов Окислительно-восстановительные реакции (ОВР). Лекция 1
Окислительно-восстановительные реакции (ОВР). Лекция 1 Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"
Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"  Характеристика химических элементов IV А группа. Углерод
Характеристика химических элементов IV А группа. Углерод Эвапориты. Химические осадки из ионных растворов
Эвапориты. Химические осадки из ионных растворов каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами
каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами Презентация на тему Дисперсные системы и растворы
Презентация на тему Дисперсные системы и растворы  Гетероциклические соединения. Нуклеиновые кислоты. (Лекция 9)
Гетероциклические соединения. Нуклеиновые кислоты. (Лекция 9) Исследование интерактивной компьютерной химической модели
Исследование интерактивной компьютерной химической модели Пробоотбор и пробоподготовка
Пробоотбор и пробоподготовка Переработка нефти
Переработка нефти Химическая связь 11 класс - Презентация_
Химическая связь 11 класс - Презентация_ Основы химической кинетики
Основы химической кинетики Презентация на тему Амины
Презентация на тему Амины  Основы аналитической химии
Основы аналитической химии