Слайд 2Антибиотики
= препараты природного или синтетического происхождения, обладающие избирательной способностью подавлять или

задерживать рост микроорганизмов
Слайд 3Классификация антибиотиков по источнику получения
Природные микробные
Природные растительные
Природные животного происхождения
Полусинтетические
Синтетические

Слайд 4Природные микробные антибиотики
1. Грибкового происхождения:
– пенициллины,
- цефалоспорины,
2. Актиномицетного происхождения:
стрептомицин,
тетрациклин,

актиномицины,
3. Бактериального происхождения (Bacillus, Pseudomonas):
грамицидин,
полимиксин,
тиротрицин.
Слайд 5Природные антибиотики растительного происхождения
Низшие растения (лишайники) - усниновая кислота
Высшие растения –

фитонциды.
Слайд 6Природные антибиотики животного происхождения
Животные теплокровные позвоночные:
- лизоцим,
эритрин,
спермин,
Животные холоднокровные позвоночные:

- экмолин,
- скваламин,
Насекомые:
иридомирмецин,
педерин.
Слайд 7Классификация антибиотиков
по химической структуре
I класс: β-лактамы
пенициллины
Цефалоспорины
II класс: макролиды и

линкозамиды
эритромицин
линкомицин
III класс: аминогликозиды
стрептомицин
гентамицин,
канамицин,
Слайд 8Классификация антибиотиков по химической структуре
IV класс: тетрациклины
доксициклин
V класс: полипептиды
полимиксин
VI

класс: полиены
нистатин
амфотерицин В
VII класс: рифамицины
Рифампицин
Слайд 9Классификация антибиотиков по химической структуре
Дополнительная группа
левомицетин
гризеофульвин

Слайд 10Классификация антибиотиков
по механизму действия
1.Нарушающие синтез клеточной стенки:
- β-лактамы
2.Нарушающие структуру

и синтез ЦПМ:
полимиксин,
полиены.
3. Нарушающие синтез белка – наиболее многочисленная группа:
аминогликозиды,
тетрациклины,
макролиды.
4.Нарушающие структуру и синтез нуклеиновых кислот:
ДНК – хинолоны,
РНК - рифампицин
Слайд 11Классификация антибиотиков
по спектру действия
1. Узкого спектра действия
– действуют на

отдельные виды или группы видов
2. Широкого спектра действия
– действуют на многие виды микроорганизмов
Слайд 12Классификация антибиотиков
по мишени действия
Антибактериальные:
цефалоспорины,
полимиксины
Антифунгальные (противогрибковые) = антимикотики:
- флуконазол
Противопротозойные:
-

метронидазол (трихопол)
Противоопухолевые:
– рубомицин,
актиномицин С,
брунеомицин.
Слайд 13Классификация антибиотиков
по типу действия
1.Бактерицидные (микробоцидные)
– убивают бактерии (микроорганизмы)
2.Бактериостатические (микробостатические)

– угнетают рост бактерий (микроорганизмов),
но не убивают их.
Слайд 14Осложнения антибиотикотерапии
со стороны макроорганизма
Токсические реакции:
прямое токсическое действие (органотропное),
феномен обострения (Герца-Геймера).
Дисбактериоз:
вторичные эндогенные

инфекции, вызванные условно-патогенной микрофлорой,
повышение восприимчивости к патогенным микробам.
Иммунопатологические реакции:
аллергические,
иммунодефицит.
Тератогенное действие.
Слайд 15Осложнения антибиотикотерапии со стороны микроорганизма
Появление атипичных форм бактерий, которые трудно идентифицировать (например

– L-форм).
2. Формирование антибиотикоустойчивости:
через 1 – 3 года применения нового антибиотика появляются устойчивые бактерии,
через 10 – 20 лет применения нового антибиотика формируется полная устойчивость к препарату.
Слайд 16Определение чувствительности бактерий
к антибиотикам

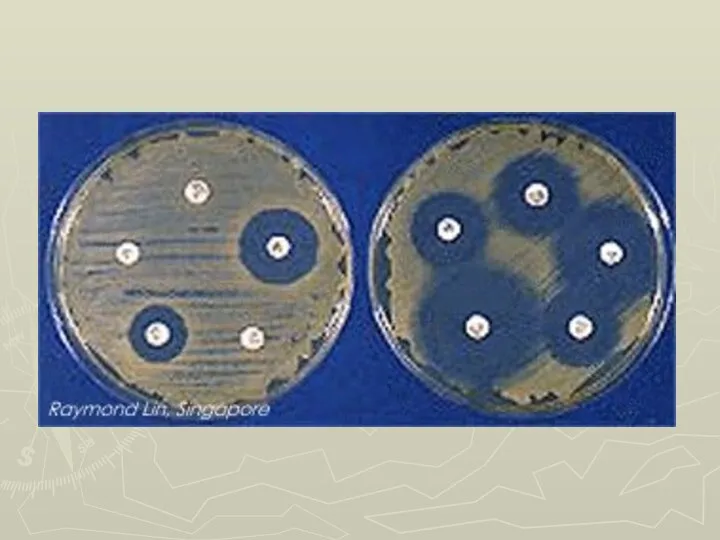
Слайд 17Метод дисков
посев тестируемого штамма на чашку Петри газоном
⇓
Наложение стандартных дисков с
антибиотиками
⇓
Инкубация
⇓
Замер зоны (диаметра) задержки роста
⇓
Вывод о чувствительности тестируемого штамма к каждому из применяемых антибиотиков (антибиотикограмма)
высокая
средняя
низкая
резистентность
Слайд 19Метод серийных разведений
Приготовление серии (обычно 8) двойных разведений антибиотика в питательной

среде
⇓
Засев сред с разведениями антибиотика тестируемым штаммом
⇓
Инкубация
⇓
Учёт бактериостатической концентрации (МИК – минимальной ингибирующей концентрации) антибиотика по отношению к тестируемому штамму (= максимальное разведение, в котором еще не наблюдается рост тестируемого штамма)
⇓
Слайд 20Метод серийных разведений
⇓
Высев из разведений, в которых не наблюдается рост тестируемых штаммов

на питательную среду без антибиотика
⇓
Инкубация
⇓
Учёт бактерицидной концентрации (МБК – минимальной бактерицидной концентрации) антибиотика по отношении к тестируемому штамму (=максимальное разведение, высев из которого на питательную среду без антибиотика не дал роста).
Слайд 21Химиотерапевтические препараты
(синтетические антибиотики)
– вещества, созданные путем химического синтеза, не встречаются в

живой природе, но похожи на антибиотики по механизму, типу и спектру действия.
Наиболее значимые препараты:
* Сульфаниламиды
* Аналоги изоникотиновой кислоты
* Хинолоны и фторхинолоны
* Имидазолы и нитроимидазолы
* Нитрофураны
Слайд 22Сульфаниламиды
основу их молекулы составляет парааминогруппа, поэтому они являются антагонистами парааминобензойной кислоты,

необходимой бактериям для синтеза фолиевой кислоты (=предшественника пуриновых и пиримидиновых оснований).
бактериостатики,
спектр действия – широкий,
активны в отношении:
стрептококков,
менингококков,
гонококков,
кишечной палочки,
возбудителей трахомы.
Единственный препарат, который продолжает широко использоваться: Ко-тримоксазол (бактрим, бисептол).
Слайд 23Аналоги изоникотиновой кислоты
1. гидразиды:
- изониазид,
- фтивазид,
- тубазид,

- метазид.
2. производные тиамида изоникотиновой кислоты:
- этионамид,
- пропионамид.
обладают бактериостатическим действием в отношении микобактерий туберкулеза.
Слайд 24Хинолоны
= препараты, блокирующие процессы репликации и транскрипции.
Первый препарат этого класса –

налидиксовая кислота:
– ограниченный спектр действия,
быстро развивается резистентность,
применяется при лечении инфекций мочевыводящих путей.
Слайд 25Фторхинолоны
ципрофлоксацин, норфлоксацин
созданы на основе хинолонов = фторированные соединения,
обладают бактерицидным действием,

спектр - широкий,
имеют разные способы введения,
хорошо переносимы,
высоко активны в месте введения.
Слайд 26Имидазолы и нитроимидазолы
Имидазолы (клотримазол)- противогрибковые препараты, действуют на уровне цитоплазматической мембраны.
Нитроимидазолы:
метранидазол,
трихопол,

– ДНК-тропные препараты,
- особенно активны против анаэробных бактерий и простейших ( трихомонады, лямблии, дизентерийная амеба).
Тип действия – микробоцидный.
Слайд 27Нитрофураны
фуразолидон, фурациллин
ДНК-тропные препараты,
Тип действия – бактерицидный, спектр – широкий.
Накапливаются

в моче в высоких концентрациях,
Применяются как уросептики для лечения инфекций мочевыводящих путей.
Слайд 28
Механизмы формирования лекарственной устойчивости
Под действием антибиотиков микроорганизмы изменяют свои свойства:
морфологические,
культуральные,

антигенные и т. п.
особенно резистентность!
Слайд 29
Механизмы формирования лекарственной устойчивости
Лекарственная устойчивость бывает:
Природной = отсутствие у микроорганизма мишени, на

которую направлено действие антибиотика,
н-р, пенициллин не действует на микоплазмы, т.к. нет Клеточной Стенки.
Приобретенной = преобразование мишени в результате мутационно-рекомбинационных изменений.
Слайд 30
Механизмы формирования приобретенной лекарственной устойчивости
А) плазмиды резистентности и транспозоны:
транспозон – 1 препарат,

плазмиды (несколько траспозонов) = несколько препаратов,
Межвидовая передача и межродовая
Слайд 31
Механизмы формирования приобретенной лекарственной устойчивости
Б) модификация мишени:
н-р, ПСБ (пенициллинсвязывающие белки):
-

участвуют в синтезе КС бактерий,
- на них действуют бета-лактамные а/б,
при мутациях появляются измененные ПСБ, на которые не действуют эти а/б.
Слайд 32
Механизмы формирования приобретенной лекарственной устойчивости
В) инактивация антибиотика с помощью ферментов бактерий
Н-р, бетта-лактамазы

=пенициллины,
амидазы – цефалоспорины,
Некоторые микроорганизмы имеют ферменты, разрушающие несколько а/б = полирезистентность
Слайд 33
Механизмы формирования приобретенной лекарственной устойчивости
Г) Эффлюкс-активное выведение а/б из микробной клетки –

осуществляется транспортными системами, которые кодируют специальные гены
Н-р, синегнойная палочка, пневмококк имеют mefген - отвечает за вывод из клетки макролидных а/б→ концентрация а/б резко снижается и он не опасен для бактерий
Слайд 34
Механизмы формирования приобретенной лекарственной устойчивости
Д) нарушение проницаемости внешних структур микробной клетки
Н-р,

при мутации у бактерий нарушается способность образовывать белки-порины, без которых клетка теряет проницаемость и приобретает устойчивость к а/б
Слайд 35
Механизмы формирования приобретенной лекарственной устойчивости
Е) формирование «метаболического шунта» :
- м/о приобретают гены,

кодирующие определенные этапы метаболического пути клетки, устойчивые к действию а/б →
= метаболизм идет по обходному пути и а/б не может его ингибировать.
Слайд 36
Пути преодоления лекарственной устойчивости
1. Сократить использование а/б с профилактической целью,
2. Периодически менять

набор препаратов в пределах одного лечебного учреждения,
3. Увеличивать лечебные дозы в допустимых пределах и вводить препарат в очаг поражения – н-р, внутриплеврально, внутрисуставно,
Слайд 37
Пути преодоления лекарственной устойчивости
4. Использовать а/б с пролонгированным действием – (иммобилизация на

носителях =полимерные соединения).
Н-р, противоопухолевый аурантин-активен 3 час, на носителе – 7 сут
Слайд 38
Пути преодоления лекарственной устойчивости
5. Использовать а/б в сочетании с другими препаратами: ферментами

или др. а/б.
Н-р, клавулановая кислота – ингибирует бетта-лактамазу→ амоксиклав (амоксициллин+клавулановая кислота),
Другие блокаторы бетта-лактамазы:
сульбактам,
тазобактам.
Слайд 39
Пути преодоления лекарственной устойчивости
6. Ограничить применение а/б в ветеринарии:
не добавлять в корм

сельскохозяйственных животных для увеличения массы антибиотики, применяемые в медицине,
7. Для консервирования продуктов не использовать а/б.
Слайд 40Проблемы химиотерапии вирусных инфекций
По химическому составу и механизмам действия различают:
химиопрепараты,
интерфероны,

индукторы эндогенных интерферонов,
иммуномодуляторы.
Слайд 41Противовирусные химиопрепараты
– синтетические лекарственные средства, механизм действия которых заключается в избирательном подавлении

отдельных этапов репродукции вирусов без существенного нарушения жизнедеятельности клеток макроорганизма.
Слайд 42
Основные противовирусные химиопрепараты:
1. Аномальные нуклеозиды:
- азидотимидин,
ацикловир,
видарабин,
рибавирин,
2.Производные адамантана:
-

адопромин,
амантадин,
ремантадин,
3. Синтетические аминокислоты:
амбен,
аминокапроновая кислота.
Слайд 43
Основные противовирусные химиопрепараты:
4. Аналоги пирофосфата:
- фоскарнет
5. Производные тиосемикарбазона:
- марборан,

- метисазон
6. Вирулицидные препараты:
- оксолин,
теброфен,
флюреналь
7. Прочие препараты:
пандовир,
хельпин,
арбидол
Слайд 44Интерфероны
Белки со сходными свойствами, выделяемые клетками организма в ответ на вторжение вируса.

Благодаря интерферонам клетки становятся невосприимчивыми по отношению к вирусу.
В зависимости от типа клеток, в которых они образуются различают α, β и γ-интерфероны.
Слайд 45Человеческий лейкоцитарный интерферон

Слайд 46Индукторы интерферона
— это вещества природного или синтетического происхождения, стимулирующие в организме человека

продукцию собственного интерферона, который способствует формированию защитного барьера, препятствующего инфицированию организма вирусами и бактериями, а также регулирует состояние иммунной системы и ингибирует рост злокачественных клеток.
Примеры: амиксин, циклоферон, кагоцел, ридостин.
Слайд 47Иммуномодуляторы
— природные или синтетические вещества, способные оказывать регулирующее действие на иммунную систему.

По характеру влияния на иммунную систему их подразделяют на:
иммуностимулирующие,
иммуносупрессивные.
Слайд 48ВАКЦИНЫ
препараты, содержащие антиген и применяемые для создания активного иммунитета.

Слайд 49Общая классификация вакцин
Живые (аттенуированные).
Убитые (инактивированные).
Химические:
компонентные или субклеточные (бактериальные)
субъединичные или субвирионные (вирусные).
Молекулярные

(анатоксины).
Нового поколения:
синтетические,
генно-инженерные
Слайд 50Живые вакцины (аттенуированные)
Получение:
отбор стойких спонтанных или индуцированных мутантов с пониженной

вирулентностью и сохраненной иммуногенностью (вакцинный штамм).
Слайд 51Живые вакцины (аттенуированные)
Общая характеристика:
поствакцинальный иммунитет ~ постинфекционному (т.к. формируется в результате

вакцинального процесса = размножении в организме вакцинного штамма и воздействия его на иммунокомпетентные клетки),
в большинстве случаев вводятся однократно,
при иммунодефицитных состояниях – крайне опасны.
Слайд 52По способу получения вакцинных штаммов живые вакцины подразделяют на:
аттенуированные,
дивергентные,
векторные.

Слайд 53Аттенуированные штаммы для вакцины возникают под воздействием:
необычной для микроба температуры культивирования,
изменения

состава питательной среды,
антибиотиков,
пассирования через организм животных;
Н-р, вакцины для профилактики:
- туберкулеза,
- чумы,
- туляремии,
- сибирской язвы,
- бруцеллеза,
-Ку-лихорадки.
Слайд 54Дивергентные вакцины
- получены путем подбора генетически близких условно-патогенных микроорганизмов, имеющих общие антигены

с патогенными микробами.
Н-р, оспенная и туберкулезная вакцины.
Слайд 55Векторные вакцины
получают методом генной инженерии, встраивая в геном вакцинного штамма ген чужеродного

антигена.
Н-р, вакцина против гепатита В получена в результате введения в оспенную вакцину гена, кодирующего HBs антиген вируса гепатита В.
Слайд 56Убитые вакцины (инактивированные)
Получение:
инактивация микроорганизма:
- температурой,
- УФ ,
- химическими веществами
в

условиях, исключающих денатурацию его антигенов.
Слайд 57Убитые вакцины (инактивированные)
Эффективность убитых вакцин ниже, чем живых.
Их вводят обычно подкожно

2-3 раза с интервалом в 10 дней с последующей ревакцинацией через 1 нед-3года.
Убитые вакцины применяют для профилактики:
брюшного тифа,
коклюша,
лептоспироза.
Слайд 58ХИМИЧЕСКИЕ ВАКЦИНЫ
(компонентные или субклеточные и субъединичные или субвирионные)
ПРЕИМУЩЕСТВА:
наиболее безопасны,
эффективность зависит

от конкретного препарата
ПОЛУЧЕНИЕ:
выделение протективных антигенов из:
бактерий (компонентные или субклеточные вакцины),
- вирусов (субъединичные или субвирионные вакцины).
Слайд 59Получение химических вакцин
антигены микробных клеток извлекают химическими методами, например, методом ферментативного переваривания

с помощью трипсина с последующим осаждением спиртом,
Выделенные антигены осаждают на адъювантах (гидроокись алюминия, фосфат кальция), которые усиливают иммунный ответ, образуют депо антигенов и стабилизируют их.
Слайд 60химические (субклеточные и субвирионные) вакцины
К субклеточным вакцинам относятся менингококковые и пневмококковые вакцины,

приготовленные из полисахаридных антигенов капсул;
к субвирионным - гриппозная на основе гемагглютитина и нейраминидазы.
Слайд 61Молекулярные вакцины (анатоксины или токсоиды)
ПОЛУЧЕНИЕ:
обработка белкового токсина 0,3% формалином при

37оС на протяжении 30 дней;
в результате белковый токсин теряет свою ядовитость, но сохраняет иммуногенность = анатоксин.
ОБЩАЯ ХАРАКТЕРИСТИКА:
самые эффективные вакцины.
Слайд 62Молекулярные вакцины (анатоксины или токсоиды)
Анатоксины применяют для профилактики:
дифтерии,
столбняка,
стафилококковой

инфекции.
Слайд 63Синтетические вакцины
получены на основе олигопептидов и олигосахаридов – это комплексные макромолекулы, состоящие

из:
антигенной детерминанты, полученной искусственным путем,
адъюванта,
неприродных полимерных носителей антигена – иммунопотенциаторов.
Синтетические вакцины разрабатываются для профилактики:
сальмонеллеза,
коли-бактериоза.
Слайд 64Генно-инженерные или рекомбинантные вакцины
Ген, отвечающий за выработку антигена патогенного микроорганизма вносят в

геном клетки дрожжей или вируса осповакцины
Н-р, вакцина против гепатита В.
Слайд 65Применение вакцин
Для профилактики (вакцинопрофилактика)
Для лечения (вакцинотерапия)

Слайд 66
Сыворотки и иммуноглобулины
Иммунные сыворотки и получаемые из них иммуноглобулины – биологические препараты,

содержащие антитела.
Они предназначены для создания пассивного иммунитета и используются как средства серопрофилактики и серотерапии.
Действие сывороток начинается сразу после введения, но срок действия ограничен периодом их сохранения в организме (2-4 недели).
Слайд 67
Сыворотки
В зависимости от источника получения различают :
гетерологичные
гомологичные сыворотки.

Слайд 68Гетерологичные сыворотки
готовят путем гипериммунизации животных (лошадей, ослов, волов) анатоксином или другими антигенами

микроорганизмов.
По направлению действия гетерологичные сыворотки делят на:
антитоксические,
антибактериальные
противовирусные.
Слайд 69 Антитоксические сыворотки
используются при лечении токсикоинфекций, так как они способны нейтрализовать

действие соответствующих токсинов,
например, сыворотка против экзотоксинов возбудителей:
- дифтерии,
- столбняка,
- ботулизма,
- холеры.
Слайд 70 Антибактериальные сыворотки
способствуют фагоцитозу и лизису микробных клеток в организме,
но

они обладают малой эффективностью и способны вызвать тяжелые осложнения.
В настоящее время применяются редко.
В практике используют иммунные сыворотки:
- противосибиреязвенную,
- противолептоспирозную,
- противостафилококковую.
Слайд 71Противовирусные сыворотки
способны инактивировать вирусы.
Их используют для лечения и профилактики:
клещевого энцефалита,
бешенства,

кори,
гриппа,
гепатитов.
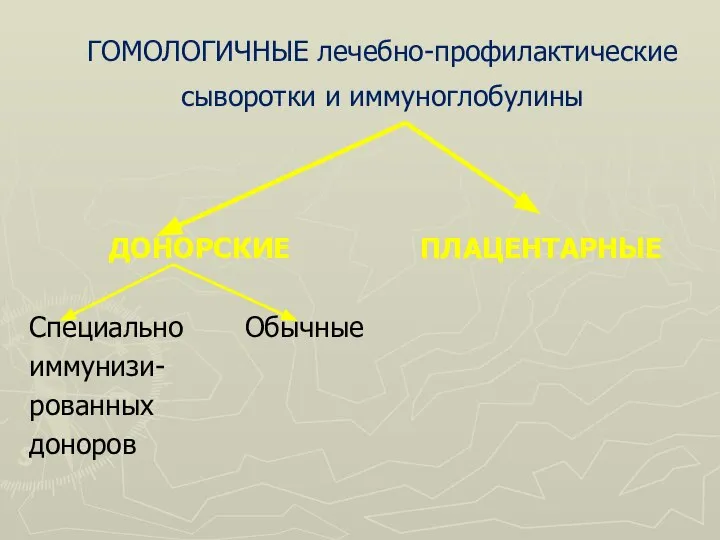
Слайд 72ГОМОЛОГИЧНЫЕ лечебно-профилактические сыворотки и иммуноглобулины
ДОНОРСКИЕ
Специально Обычные
иммунизи-
рованных
доноров
ПЛАЦЕНТАРНЫЕ
Слайд 73Гомологичные сыворотки
получают из:
крови доноров, перенесших инфекционное заболевание:
- коревая,
-

паротитная,
- оспенная.
специально иммунизированных людей-доноров:
- противостолбнячная,
- противоботулиническая),
плацентарной или абортной крови.
Гомологичные сыворотки менее иммуногенны.
Слайд 74
Иммуноглобулины
– специфические белки, полученные из сывороток путем очистки от балластных веществ.
Препараты

иммуноглобулинов, полученные из крови человека не иммуногенны для него, тогда как гетерологичные иммуноглобулины являются иммуногенными.
Слайд 75
Иммуноглобулины
Выпускают 2 вида иммуноглобулинов:
Нормальный иммуноглобулин
Специфический иммуноглобулин

Слайд 76 Нормальный иммуноглобулин
– готовят из смеси сывороток крови разных людей.
Он содержит

антитела против разных возбудителей: например, кори, гриппа, полиомиелита, коклюша, дифтерии и других.










































































 Эффективная забота о нейрореанимационном пациенте
Эффективная забота о нейрореанимационном пациенте Общие вопросы клинической трансфузиологии
Общие вопросы клинической трансфузиологии Физиотерапия в стоматологии
Физиотерапия в стоматологии Синтетические противодиабетические средства. Препараты, уменьшающие инсулинорезистентность тканей
Синтетические противодиабетические средства. Препараты, уменьшающие инсулинорезистентность тканей Психопатология мышления (2 часа) (Лекция 2)
Психопатология мышления (2 часа) (Лекция 2) Первая помощь при повреждениях кожи, тепловом и солнечном ударах. 9 класс
Первая помощь при повреждениях кожи, тепловом и солнечном ударах. 9 класс Болезни органов дыхания
Болезни органов дыхания Анатомия толстой кишки
Анатомия толстой кишки Слуховой аппарат для пожилых людей
Слуховой аппарат для пожилых людей Презентация новая для педиатров перед с эфф
Презентация новая для педиатров перед с эфф Angina pectoris. Стенокардия
Angina pectoris. Стенокардия Классификация медицинских отходов по степени их опасности
Классификация медицинских отходов по степени их опасности Антибіотики
Антибіотики Неврологические поражения при ДБСТ
Неврологические поражения при ДБСТ Правовые документы об основах охраны здоровья граждан в Российской Федерации
Правовые документы об основах охраны здоровья граждан в Российской Федерации Global Handwashing Day
Global Handwashing Day Реконструкция зубов в эстетической стоматологии
Реконструкция зубов в эстетической стоматологии Оздоровительные технологии
Оздоровительные технологии Bacteria-binding polymers: a novel way to reduce bacterial load in infection
Bacteria-binding polymers: a novel way to reduce bacterial load in infection Понятие (гипо) гипердинамии
Понятие (гипо) гипердинамии Колоректальный рак. Онконастороженность и ранняя диагностика
Колоректальный рак. Онконастороженность и ранняя диагностика Регуляция иммунных процессов
Регуляция иммунных процессов Күйік
Күйік Сеть стоматологических клиник Мега-дент
Сеть стоматологических клиник Мега-дент Компрессионный трикотаж
Компрессионный трикотаж Изоантигенная несовместимость крови матери и плода
Изоантигенная несовместимость крови матери и плода Эрмасса. Основное показание
Эрмасса. Основное показание Механизм активации слюноотделения во время прорезывания зубов
Механизм активации слюноотделения во время прорезывания зубов