Слайд 2Антибактериальная терапия пациентов, находящихся в отделениях реанимации и интенсивной терапии (ОРИТ), представляет

сложную проблему.
Это связано с тем, что от адекватности выбора антибиотиков при инфекциях в ОРИТ нередко зависит жизнь пациента. Убедительно показано, что неверный выбор антибактериального препарата ухудшает исход болезни и является наиболее значимым
независимым фактором риска летального исхода у этих пациентов [1].
Однако у пациентов в ОРИТ адекватность выбора антибиотиков определяется не только
in vitro чувствительностью к ним микроорганизма,
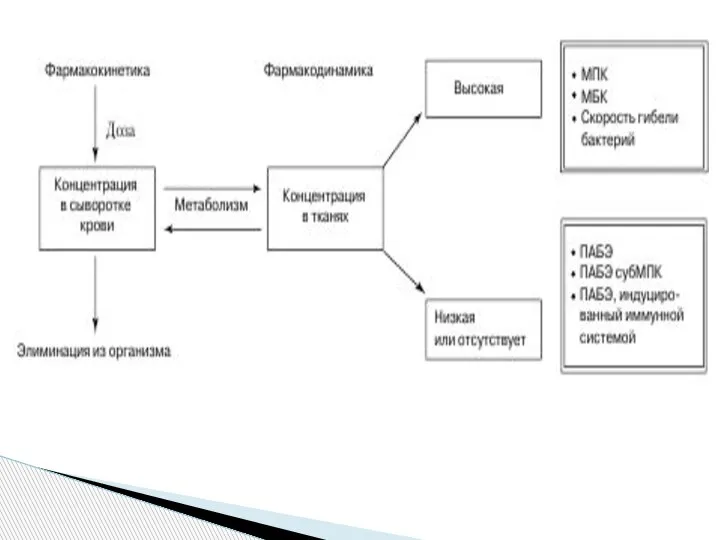
вызвавшего инфекцию, но и во многом зависит от соотношения фармакокинетических (ФК) и фармакодинамических (ФД) параметров (рис. 1).
Фармакокинетика антимикробных препаратов,
как и любых других лекарственных средств, складывается из таких процессов, как абсорбция, метаболизм, распределение в биологических жидкостях и тканях, выведение из организма. ФД параметры
отражают зависимость между концентрацией антибиотика в плазме или тканях и его антимикробным эффектом.
Активность антибиотика определяется такими показателями, как минимальная подавляющая концентрация (МПК), минимальная бактерицидная
Слайд 3концентрация (МБК), а также скорость бактерицидного эффекта.
Антибиотики, достигающие высокой концентрации в тканях

и сыворотке крови, обычно дают высокую эффективность. Однако даже при относительно
невысокой концентрации некоторые классы антимикробных препаратов проявляют антимикробное действие, обеспечивающее достаточную эффективность. Это, в частности, связано с такими феноменами, как постантибиотический эффект (ПАБЭ),
ПАБЭ субингибирующей концентрации препарата, а также ПАБЭ, потенциированный (индуцированный) иммунной системой.
Согласно современным представлениям, все антибиотики можно разделить на две основные группы:
1) концентрационноозависимые;
2) времязависимые [2].
К первой группе, например, относятся аминогликозиды и фторхинолоны.
Вторая группа включаетпочти все β лактамные антибиотики, активность которых лишь до определенного уровня зависитотконцентрации, достигаемой в сыворотке крови.
Эффективность препаратов второй группы
определяется главным образом временем, в течение
которого концентрация антибиотика превышает его МПК для определенного возбудителя. В то же
Слайд 4время для препаратов первой группы бактерицидный эффектпрямо пропорционален их концентрации, что нехарактерно

для времязависимых антибиотиков.
В последние годы широко проводятся исследования, в которых на моделях инфекции in vitro и in vivo изучаются различные режимы дозирования
антибиотиков.
Их цель – установить, какие соотношения ФК и ФД показателей могут оказаться полезными для прогнозирования антимикробной активности различных классов препаратов.
В экспериментах на in vitro моделях инфекции установлено, что соотношение время больше (выше) МПК (время > МПК) является основным параметром, определяющим эффективность времязависимых антибиотиков, таких, как β лактамы, гликопептиды и эритромицин.
В то же время такие ФК/ФД соотношения, как Сmax/МПК, площадь под фармакокинетической кривой/МПК (ПФК/МПК), представляют наиболее
важные параметры, позволяющие определить эффективность концентрационноозависимых препаратов, к которым, в частности, относятся хинупристин/дальфопристин, новые препараты из
группы кетолидов, полусинтетические макролиды,(кларитромицин, азитромицин).
Слайд 5Более того, в нескольких клинических исследованиях продемонстрировано, что ФК/ФД параметры являются важными

прогностическими показателями (предикторами) исхода болезни – достижения эрадикации возбудителя или клинического выздоровления [2].
Не менее важно, что ФК/ФД параметры позволяют прогнозировать селекцию резистентности
бактерий и находить пути к ее предотвращению.
Последнее, в свою очередь, является одним из
Слайд 6 основных факторов, требующих внимания к пациентам, находящихся в ОРИТ.
В настоящее время

нет идеального препарата
для лечения тяжелых инфекций у пациентов, находящихся в ОРИТ. Среди антибиотиков, которые
могут быть использованы в качестве первой линии
антимикробной терапии у этой категории пациентов, предпочтение следует отдавать β лактамам:
карбапенемам, цефалоспоринам III и IV поколений, комбинациям уреидопенициллинов с ингибиторами β лактамаз. Для достижения максимальной
эффективности и/или расширения спектра действия их можно сочетать с аминогликозидами, гликопептидами или фторхинолонами.
Слайд 7Концентрационноозависимые препараты
Для выбора препаратов, обладающих максимальной эффективностью, важно учитывать их ФК/ФД профили.
Одним

из первых исследований, продемонстрировавших влияние ФК/ФД параметров антибиотиков на их клиническую эффективность, стала опубликованная в 1987 г. оценка связи между значением
отношения Сmax/ МПК и частотой клинической эффективности терапии у 236 пациентов (с инфекцией,
вызванной грамотрицательными микроорганизмами), лечившихся различными аминогликозидами
(гентамицином, тобрамицином, амикацином) [3].
Согласно полученным результатам, наибольшие
возможности для получения удовлетворительного
клинического ответа на терапию создаются при достижении соотношения Сmax/ МПК более 8 для любого из перечисленных аминогликозидов. Поэтому
для достижения максимального соотношения
Cmax/МПК аминогликозиды лучше назначать один
раз в сутки.
Слайд 9В другом клиническом исследовании оценивалась зависимость между ПФК24/МПК (ПФКИ –
площадь под фармакокинетической

кривой ингибирования) ципрофлоксацина и частотой эрадикации
возбудителя у 74 пациентов с инфекциями дыхательных путей в ОРИТ. Наиболее высокая частота
эрадикации возбудителя наблюдалась в том случае, если при лечении ципрофлоксацином удавалось достичь значения ПФК24/ МПК более 125. В противном случае вероятность микробиологического
выздоровления составляла не более 30% [4].
Слайд 10Времязависимые препараты
В отношении времязависимых препаратов, к которым относятся β掀лактамы, остается нерешенным
вопрос о

том, какой режим дозирования позволяет
достичь максимальной эффективности: введение
равных доз через короткие интервалы или постоянная инфузия. В целом это зависитотособенностей выбранного для лечения препарата.
Так, например, в нашем предыдущем исследовании наиболее эффективным режимом терапии цефтазидимом 8 пациентов с инфекцией в ОРИТ, позволявшим достичь максимально высоких значений время > МПК, явилось введение в начале лечения
нагрузочной дозы (1 г) с последующей длительной
внутривенной инфузией 3 г препарата (общая суточная доза–4г) и длительной внутривенной инфузией 4 г препарата в последующие дни. Такой
способ введения обеспечиваетсохраняющиеся на
протяжении всего курса терапии оптимальную концентрацию цефтазидима в сыворотке крови и высокое значение ПФК данного антибиотика.
Слайд 11Так, например, соотношение ПФК24/ МПК цефтазидима для P. aeruginosa в 11й день

терапии, когда используется нагрузочная доза, составляет
112,8 мг/(л Ч ч). В то же время значение этого параметра снижается на 22й и 33й дни терапии, в связи с чем при лечении инфекций, вызванных этим возбудителем, целесообразно назначать цефтазидим в комбинации с аминогликозидом.
По нашим данным, лучшим аминогликозидом
для этой цели является амикацин. Цефтазидим
также можно сочетать с фторхинолонами – ципрофлоксацином и левофлоксацином.
Слайд 12Карбапенемы
Как правило, карбапенемы, к которым относятся имипенем и меропенем, описываются как времяя
зависимые

препараты. Однако при сравнении
параметров, определяющих бактерицидную активность в отношении P. aeruginosa, обнаруживается
выраженная зависимость эффекта от концентрации
[5]. Для карбапенемов, как и для тикарциллина, характерно усиление антимикробной активности по мере увеличения концентрации препарата in vitro.
Оба препарата из группы карбапенемов обладают
достаточно высоким ПАБЭ в отношении некоторых
наиболее распространенных грамотрицательных
возбудителей инфекций в ОРИТ: Escherichia coli,
Pseudomonas aeruginosa, Staphylococcus aureus [6–10].
В целом как для имипенема, так и для меропенема важным ФК/ФД соотношением, позволяющим
оценить антимикробную активность по меньшей
мере на животных моделях, является процент времени от длительности интервала дозирования, в
течение которого концентрация препарата превышает его МПК для конкретного возбудителя
Слайд 13Так, в экспериментах на модели инфекции мягких тканей у мышей максимальная бактерицидная
активность

имипенема достигалась в том случае, если время выше МПК составляло не менее 30–40%
от длительности интервала дозирования [11].
ФК характеристики обоих карбапенемов обычно описываются как очень сходные. Как видно из
данных табл. 1, период полувыведения и мипенема
и меропенема составляет около 1 ч. Оба препарата
имеют достаточно большой объем распределения и
очень сходную долю почечной экскреции.
Тем не менее недавно были опубликованы
результаты как минимум 3 сравнительных исследований на здоровых добровольцах, в которых
Слайд 16продемонстрированы некоторые преимущества имипенема по сравнению с меропенемом [12–14]. Например, при использовании
![продемонстрированы некоторые преимущества имипенема по сравнению с меропенемом [12–14]. Например, при использовании](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1022557/slide-15.jpg)
имипенема достигалась более высокая концентрация препарата в сыворотке крови. Более того, значение ПФК имипенема составило 94–96 мг/(л Ч ч), тогда как ПФК меропенема оказалась равной 70–77 мг/(л Ч ч). Для меропенема оказались более высокими плазменный и почечный клиренсы (табл. 1).
Так, в одном из этих исследований, в котором
участвовали 12 здоровых добровольцев, у имипенема выявлены более высокие, чем у меропенема,
показатели ПФК: 96,1±14,4 мг/(л Ч ч) против
70,5±10,3 мг/(л Ч ч) [13].
Слайд 17В связи с выявленными различиями ФК/ФД
профилей имипенема и меропенема нами проведено сравнительное

клиническое исследование различий ФК параметров обоих карбапенемов. В его
ходе оценивалась концентрация, развивавшаяся в
сыворотке крови и моче после однократного введения в виде 200минутной внутривенной инфузии 1 г каждого антибиотика.
В исследование были включены 19 госпитализированных в ОРИТ пациентов старше 18 лет.
Первая группа (n=9) получала имипенем,
вторая (n=10) – меропенем. Все пациенты были сгруппированы по полу, возрасту и характеру
Слайд 19патологии и оценены по шкалам SAPS II и SOFA.
По возрасту, массе тела,

уровням в крови креатинина и общего белка, оценкам по шкалам SAPS II
и SOFA больные обеих групп существенно не отличались.
Образцы мочи и венозной крови собирали в течение первых 8 ч после введения антибиотика. Сразу после получения пробы крови ее центрифугировали, сыворотку замораживали в жидком азоте и
хранили при температуре минус 80°С до проведения исследования.
Концентрацию антибиотиков в сыворотке крови
и моче исследовали трехкратно микробиологическим методом путем разведения в агаре. Для определения активности имипенема использовали агар
BHI (Difco) и штамм Bacillus subtilis ATCC 6633,
меропенема – Nutrient Agar (Difco) и штамм
Escherichia coli NHIJ
Слайд 20ФК параметры рассчитывали с использованием
компьютерной программы Syphar 4.0 (SIMED).
Для статистического анализа применяли

метод наименьшей квадратической регрессии и открытую
двухстороннюю математическую модель.
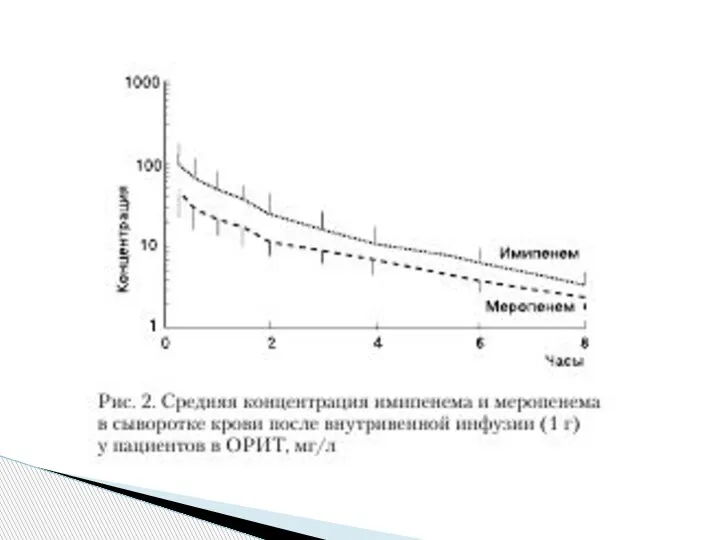
По полученным данным, средняя концентрация
имипенема, развивавшаяся в сыворотке крови после внутривенной инфузии 1 г препарата, значительно превышала таковую у меропенема (рис. 2).
Выявлены статистически значимые различия
между основными ФК параметрами обоих антибиотиков, такими, как максимальная концентрация препарата в сыворотке крови (Сmax) и ПФК. При этом
имипенем, как видно из данных табл. 2, имел более
высокий, чем у меропенема, ФК/ФД профиль: Сmax
составила 95,8±50,5 для имипенема и 46,6±14,7 – для
меропенема (p<0,01), ПФК0→∞ – 226,4±85,3 и
99,5±23,9 мг/(лЧч) для имипенема и меропенема соо
ответственно (p<0,01). Периоды полувыведения
(Т1/2) обоих антибиотиков оказались сходными
Слайд 21В другом исследовании, проведенном M. Palazzo
и соавт. (служба реанимации и интенсивной терапии,

госпиталь «Чэринг Кросс», Лондон, Великобритания; неопубликованные данные), оценивалась
концентрация меропенема, развивавшаяся в сыворотке крови после внутривенного введения у
Слайд 24пациентов, госпитализированных в ОРИТ. Использовались 2 различных режима терапии:
1) болюсное введение препарата

в дозе1г3раза
в сутки (n = 6);
2) введение нагрузочной дозы (1 г) с последующей постоянной инфузией 3 г препарата в течение
24ч(n = 8).
Необходимо отметить, что сывороточная концентрация меропенема, достигавшаяся у пациентов в обеих группах, оказались значительно ниже, чем у
имипенема, зарегистрированная в описанном исследовании. При этом ФК преимущества имипенема наблюдались при его сравнении как с первым,
так и со вторым режимом введения меропенема.
Слайд 25Одно из наиболее вероятных объяснений различий ФК профилей карбапенемов в сыворотке крови
–

неодинаковая степень их проникновения в ткани и жидкости организма. Однако, согласно результатам нескольких исследований, имипенем и меропенем
обладаюточень сходной степенью проникновения в ткани [15]. Другими возможными причинами различий ФК профилей карбапенемов могут быть разные
величины таких показателей, как общий и почечный
Слайд 26клиренсы препаратов, объем распределения и, вероятно, особенности тканевого метаболизма каждого.
Важные различия в

характеристиках имипенема и меропенема могут быть выявлены при сравнении
концентраций, развивающихся в сыворотке крови при внутривенном введении каждого препарата, с теоретическими МПК90 для различных
возбудителей, являющихся наиболее частыми причинами инфекций у пациентов в ОРИТ.
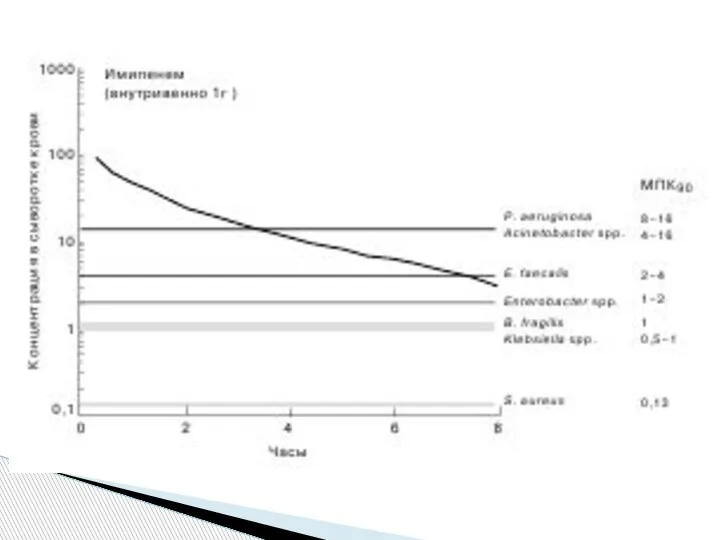
Так, по данным нашего исследования, при внутривенном введении 1 г
имипенема в сыворотке крови достигается концентрация, превышающая
8 мг/л и являющаяся бактерицидной в отношении большинства возбудителей, имеющих МПК90 ниже этого
значения (рис. 3)
Слайд 27К таким патогенам относятся
S. aureus, Klebsiella spp., Bacteroides fragilis, Enterobacter spp., Enterococcus

faecalis, некоторые штаммы Acinetoo bacter spp. и P. aeruginosa.
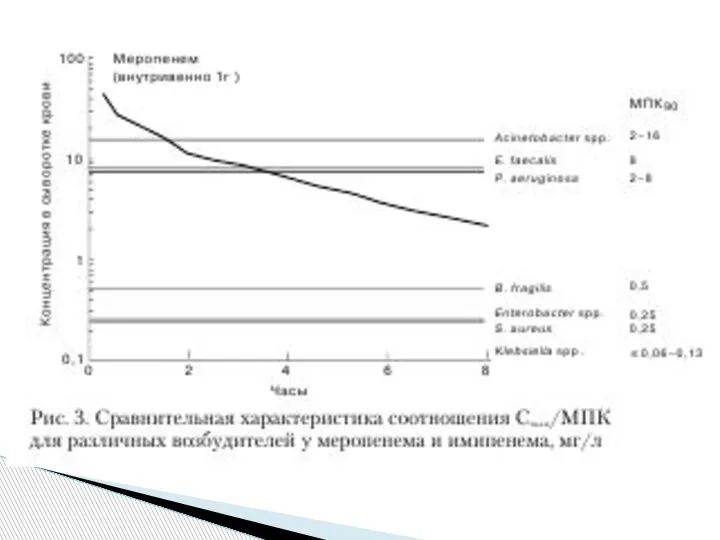
В противоположность имипенему сывороточная концентрация, развивающаяся при использовании
меропенема, эффективна только в
отношении возбудителей, имеющих
МПК данного препарата не более 4 мг/л (рис. 3).
Этим объясняется более низкая активность меропенема в отношении большинства штаммов P. Aerugii nosa, E. faecalis и Acinetobacter spp.
Для того чтобы судить о преимуществах какого либо карбапенема, необходимо сравнить их клиническую эффективность
Слайд 28Так, например, суммарные результаты нескольких рандомизированных открытых сравнительных клинических исследований эффективности имипенема

и меропенема, использовавшихся в
качестве эмпирической терапии пациентов с тяжелы ми инфекциями (n = 561), продемонстрировали сходную частоту эрадикации возбудителя, составившую
67–94% для меропенема и 60–88% – для имипенема.
Не выявлено и существенных различий в частоте удовлетворительных клинических ответов на терапию, составившей 76–88 и 68–85% для меропенема и имипенема соответственно [16–18]
Слайд 29Исходя из современных представлений о фармакокинетике и фармакодинамике антибиотиков,
можно сделать следующие

выводы, касающиеся
применения отдельных препаратов у пациентов с
инфекцией в ОРИТ:
1) для достижения максимального значения
Сmax/ МПК аминогликозиды должны назначаться1 раз в сутки;
2) для поддержания стабильной сывороточной
концентрации β쯐лактамных антибиотиков, превышающих МПК для отдельных возбудителей, их
Слайд 30следует вводить через короткие интервалы времени или постоянно внутривенно;
3) на основании приведенных

ФК характеристик карбапенемов наиболее эффективные значения
время > МПК (≥50%) достигаются при использовании имипенема в дозе1г 3раза в сутки в отношении возбудителей, имеющих МПК ≤8мг/л,меропенема в отношении возбудителей, имеющих МПК
≤4 мг/л; только при лечении тяжелых инфекций,
вызванных P. aeruginosa и Acinetobacter spp. наиболее предпочтительными могут оказаться сокращение интервала дозирования и увеличение дозы вводимого препарата до 1 г каждые 6 ч;













![продемонстрированы некоторые преимущества имипенема по сравнению с меропенемом [12–14]. Например, при использовании](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1022557/slide-15.jpg)











 Экскурсия в аптеку
Экскурсия в аптеку Опухоли молочной железы
Опухоли молочной железы Сердечные гликозиды
Сердечные гликозиды Уход до и после пластических операций
Уход до и после пластических операций Профилактика старения. Реабилитация. Лекция 7
Профилактика старения. Реабилитация. Лекция 7 Признаки язвы желудка
Признаки язвы желудка Individual work
Individual work Das britische Unternehmen Steeper
Das britische Unternehmen Steeper Клетки крови
Клетки крови Акушерлік іс және гинекология кафедрасы
Акушерлік іс және гинекология кафедрасы Медицинская психология. Этика и деонтология. Психология личности и индивидуальных различий
Медицинская психология. Этика и деонтология. Психология личности и индивидуальных различий Айырша бездің топографиялық анатомиясы. Балалардағы ерекшеліктері
Айырша бездің топографиялық анатомиясы. Балалардағы ерекшеліктері Гимнастические комплексы упражнений для детей первого года жизни
Гимнастические комплексы упражнений для детей первого года жизни Гиперплазия эмали (эмалевые жемчужины)
Гиперплазия эмали (эмалевые жемчужины) Операции на селезёнке
Операции на селезёнке Диагностика ВИЧ-инфекции
Диагностика ВИЧ-инфекции Заболевания легких
Заболевания легких Торакальная хирургия
Торакальная хирургия Острая местная гнойно-хирургическая инфекция
Острая местная гнойно-хирургическая инфекция Физические упражнения, как средство реабилитации после травм суставов
Физические упражнения, как средство реабилитации после травм суставов Техника безопасности на занятиях гимнастикой
Техника безопасности на занятиях гимнастикой Эпидемии. Массовое распространение инфекционных болезней
Эпидемии. Массовое распространение инфекционных болезней Хромосомные болезни
Хромосомные болезни Беседа медсестры. Витамины и здоровье
Беседа медсестры. Витамины и здоровье Патология репродуктивной системы у собак
Патология репродуктивной системы у собак Нормирование труда в здравоохранении
Нормирование труда в здравоохранении Пирамидная система человека
Пирамидная система человека Кровоснабжение и иннервация жевательного аппарата
Кровоснабжение и иннервация жевательного аппарата