Слайд 2АКТУАЛЬНОСТЬ
Актуальность возможности использования показателей протеолитических систем для оценки прогноза продиктована доказательством их
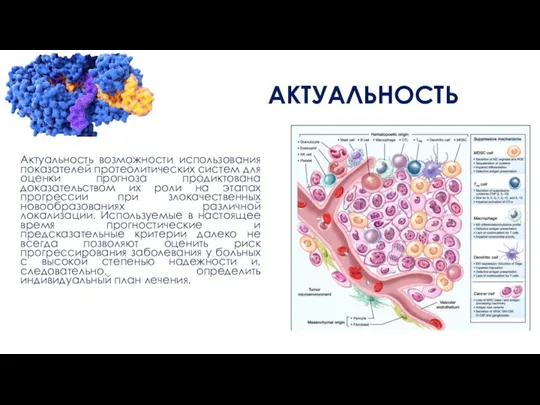
роли на этапах прогрессии при злокачественных новообразованиях различной локализации. Используемые в настоящее время прогностические и предсказательные критерии далеко не всегда позволяют оценить риск прогрессирования заболевания у больных с высокой степенью надежности и, следовательно, определить индивидуальный план лечения.
Слайд 3АКТУАЛЬНОСТЬ
Поэтому проблема персонифицированного подхода к лечению онкологических больных имеет большое научное и

практическое значение. Поиск молекулярных маркеров прогноза течения заболевания приобретает большое значение. Кроме того, содержание и активность протеасом в тканях, по-видимому, могут отражать чувствительность опухолей к традиционным цитостатическим и таргетным препаратам.
Слайд 4РЕЗУЛЬТАТЫ
Фенотип злокачественной опухоли формируется в результате изменения содержания патогенетически значимых белков в
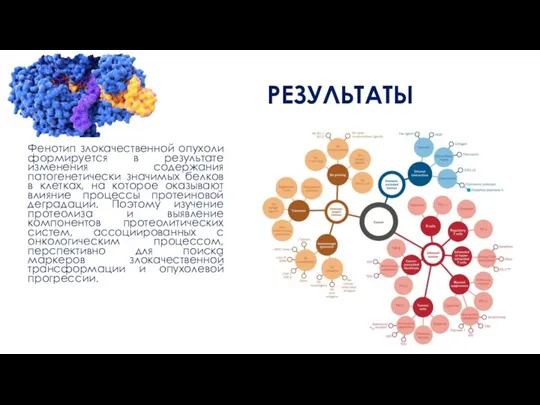
клетках, на которое оказывают влияние процессы протеиновой деградации. Поэтому изучение протеолиза и выявление компонентов протеолитических систем, ассоциированных с онкологическим процессом, перспективно для поиска маркеров злокачественной трансформации и опухолевой прогрессии.
Слайд 5РЕЗУЛЬТАТЫ
На биологические характеристики опухоли может повлиять постоянное изменение протеома, которое происходит под
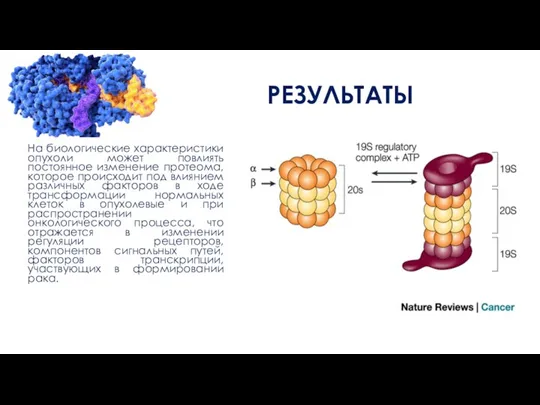
влиянием различных факторов в ходе трансформации нормальных клеток в опухолевые и при распространении онкологического процесса, что отражается в изменении регуляции рецепторов, компонентов сигнальных путей, факторов транскрипции, участвующих в формировании рака.
Слайд 6РЕЗУЛЬТАТЫ
Одним из основных путей регуляции состава и качества протеома является протеолиз, опосредуемый
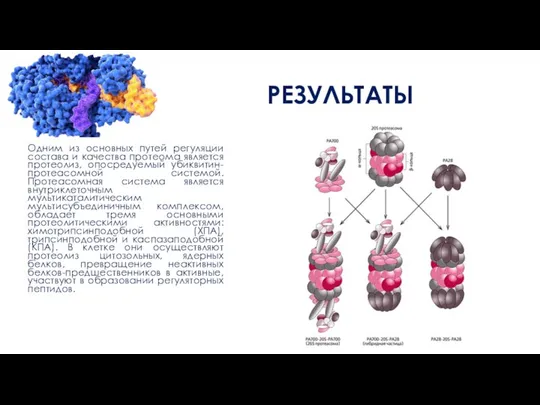
убиквитин-протеасомной системой. Протеасомная система является внутриклеточным мультикаталитическим мультисубъединичным комплексом, обладает тремя основными протеолитическими активностями: химотрипсинподобной (ХПА), трипсинподобной и каспазаподобной (КПА). В клетке они осуществляют протеолиз цитозольных, ядерных белков, превращение неактивных белков-предшественников в активные, участвуют в образовании регуляторных пептидов.
Слайд 7РЕЗУЛЬТАТЫ
Каталитические комплексы протеасомной системы представлены двумя пулами: 20S- и 26S-протеаcомы. Непосредственно протеолиз
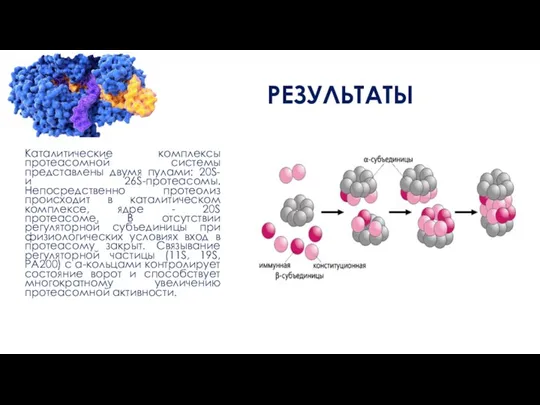
происходит в каталитическом комплексе, ядре - 20S протеасоме. В отсутствии регуляторной субъединицы при физиологических условиях вход в протеасому закрыт. Связывание регуляторной частицы (11S, 19S, РА200) с а-кольцами контролирует состояние ворот и способствует многократному увеличению протеасомной активности.
Слайд 8РЕЗУЛЬТАТЫ
Связывание регуляторной частицы (11S, 19S, РА200) с а-кольцами контролирует состояние ворот и
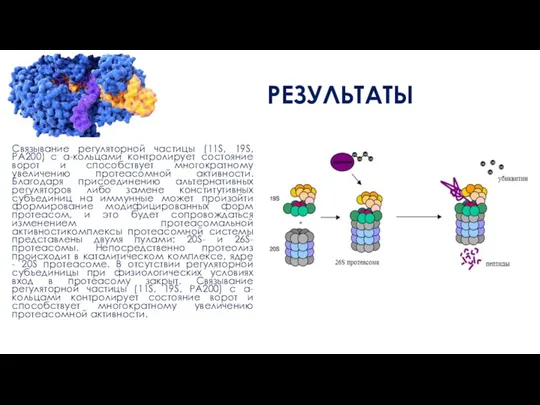
способствует многократному увеличению протеасомной активности. Благодаря присоединению альтернативных регуляторов либо замене конститутивных субъединиц на иммунные может произойти формирование модифицированных форм протеасом, и это будет сопровождаться изменением протеасомальной активностикомплексы протеасомной системы представлены двумя пулами: 20S- и 26S-протеаcомы. Непосредственно протеолиз происходит в каталитическом комплексе, ядре - 20S протеасоме. В отсутствии регуляторной субъединицы при физиологических условиях вход в протеасому закрыт. Связывание регуляторной частицы (11S, 19S, РА200) с а-кольцами контролирует состояние ворот и способствует многократному увеличению протеасомной активности.
Слайд 9РЕЗУЛЬТАТЫ
Протеасомы играют важную роль в патогенезе злокачественных опухолей. Продвижение клетки по клеточному

циклу регулируется специфическими белками - циклинами путем последовательной активации циклинзависимых киназ (CDK). Циклины являются достаточно нестабильными и существуют в клетке непродолжительное время. Их наличие и количество в клетке контролируется, с одной стороны, факторами транскрипции и, с другой стороны, протеасом-зависимой деградацией.
Слайд 10РЕЗУЛЬТАТЫ
Убиквитин-протеасомная система принимает участие как в разрушении самих циклинов, их комплексов, так

и в регуляции стабильности CDK-ингибиторов. Убиквитин-протеасомная система может играть важную роль не только в стимуляции пролиферации, но и в приобретении трансформированными клетками невосприимчивости к антиростовым сигналам, деградируя наравне с каспазами белок гена ретинобластомы рRb при участии убиквитин-лигазы Mdm2 и разрушая многие компоненты сигнального пути, опосредованного TGF-p, важного рост-ингибирующего цитокина. Кроме того, убиквитин-протеасомная система вовлечена в регуляцию апоптоза.
Слайд 11РЕЗУЛЬТАТЫ
Многие ядерные белки, опосредующие программируемую клеточную гибель, являются субстратами для протеасом: транскрипционные
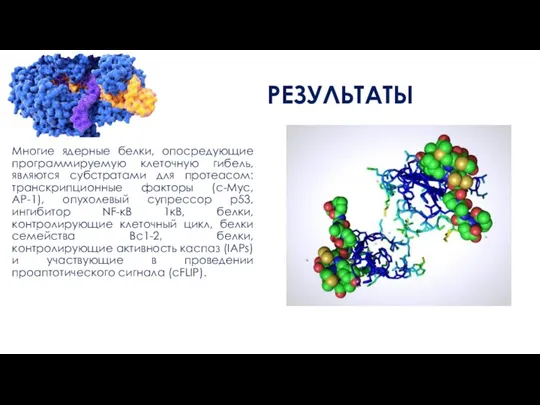
факторы (c-Myc, AP-1), опухолевый супрессор р53, ингибитор NF-кВ 1кВ, белки, контролирующие клеточный цикл, белки семейства Вс1-2, белки, контролирующие активность каспаз (IAPs) и участвующие в проведении проаптотического сигнала (cFLIP).
Слайд 12РЕЗУЛЬТАТЫ
Другим важным молекулярным механизмом развития и прогрессирования рака является внутриклеточный протеолиз, опосредованный

кальпаиновой системой. Кальпаины представляют собой кальций-зависимые цитозольные цистеиновые протеиназы; в настоящее время известно, что в состав кальпаиновой системы входят 15 протеаз.
Слайд 13РЕЗУЛЬТАТЫ
Кальпаиновая система деградации белков также осуществляет разрушение большого количества внутриклеточных белков, в
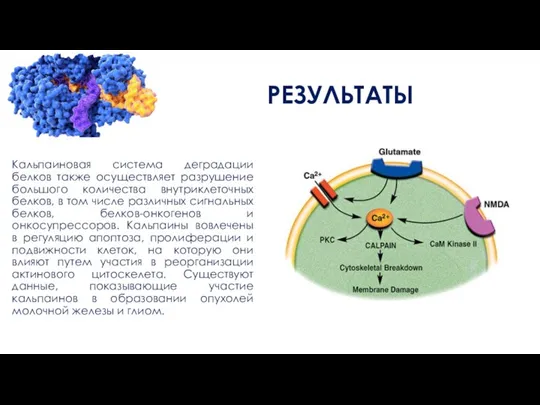
том числе различных сигнальных белков, белков-онкогенов и онкосупрессоров. Кальпаины вовлечены в регуляцию апоптоза, пролиферации и подвижности клеток, на которую они влияют путем участия в реорганизации актинового цитоскелета. Существуют данные, показывающие участие кальпаинов в образовании опухолей молочной железы и глиом.












 Основные функции мелатонина
Основные функции мелатонина Основы цитологии. Клетка
Основы цитологии. Клетка Биологическое загрязнение и здоровье человека
Биологическое загрязнение и здоровье человека Практический материал для проведения психолого-педагогического обследования
Практический материал для проведения психолого-педагогического обследования Частная психопатология
Частная психопатология Женский алкоголизм
Женский алкоголизм Гипофиздің аденомасы
Гипофиздің аденомасы Гистеросальпингография
Гистеросальпингография Опухоль молочной железы
Опухоль молочной железы Осторожно, пневмония
Осторожно, пневмония Патология белой крови - новая 2019
Патология белой крови - новая 2019 Офтальмохирургия
Офтальмохирургия 3Struktura_i_obyom_pervoy_pomoschi (1)
3Struktura_i_obyom_pervoy_pomoschi (1)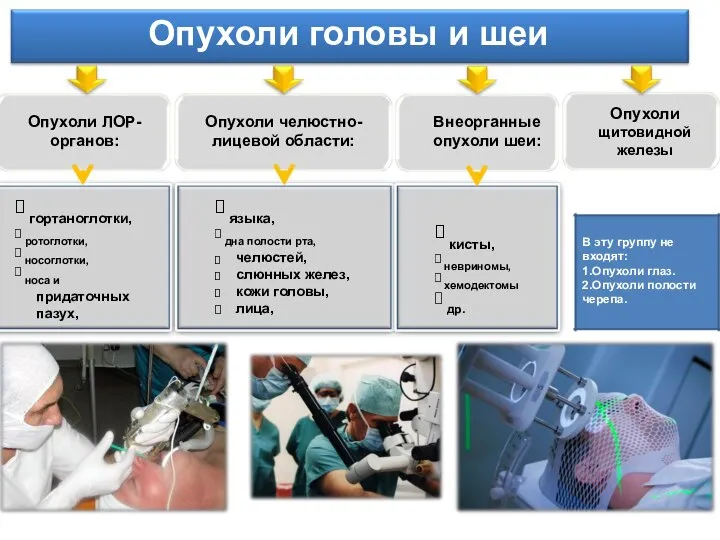 Опухоли головы и шеи
Опухоли головы и шеи Правила наложения повязок различных типов
Правила наложения повязок различных типов Аппендицит. Локализация червеобразного отростка
Аппендицит. Локализация червеобразного отростка Методы и режимы стерилизации. Методы контроля паровой и воздушной стерилизации
Методы и режимы стерилизации. Методы контроля паровой и воздушной стерилизации Сальмоннелёз
Сальмоннелёз Prezentatsia_3 (1)
Prezentatsia_3 (1) Диабетическая нефропатия. Патогенез
Диабетическая нефропатия. Патогенез Ca-Mg Complex. Ca і Mg в організмі
Ca-Mg Complex. Ca і Mg в організмі Аталық без рагі
Аталық без рагі Злокачественная мезотелиома
Злокачественная мезотелиома Краски и лаки для отделки помещений
Краски и лаки для отделки помещений Правила питания беременной женщины
Правила питания беременной женщины Цистит. Виды цистита. Лечение цистита
Цистит. Виды цистита. Лечение цистита Бронхоэктатическая болезнь
Бронхоэктатическая болезнь Влияние шовного материала с антибактериальным покрытием на снижение раневой инфекции во внутриротовой хирургии
Влияние шовного материала с антибактериальным покрытием на снижение раневой инфекции во внутриротовой хирургии