Слайд 3Химические свойства
Все элементы трехвалентны, но с повышением атомной массы приобретает значение валентность,

равная единице (Tl в основном одновалентен).
Основность гидроксидов R(OH)3 возрастает с увеличением атомной массы (H3BO3) - слабая кислота, Al(OH)3 и Ga(OH)3 - амфотерные основания, ln(OH)3 и Tl(OH)3 -типичные основания, TlOH - сильное основание).
Металлы подгруппы алюминия (Al, Ga, In, Tl) химически достаточно активны (реагируют с кислотами, щелочами (Al, Ga), галогенами).
Соли элементов подгруппы алюминия в большинстве случаев подвергаются гидролизу по катиону. Устойчивы лишь соли одновалентного таллия.
Al и Ga защищены тонкой оксидной пленкой; Tl разрушается при действии влажного воздуха, (хранят в керосине).
Слайд 5Получение алюминия и его соединений

Слайд 6Реакции алюминия с простыми веществами
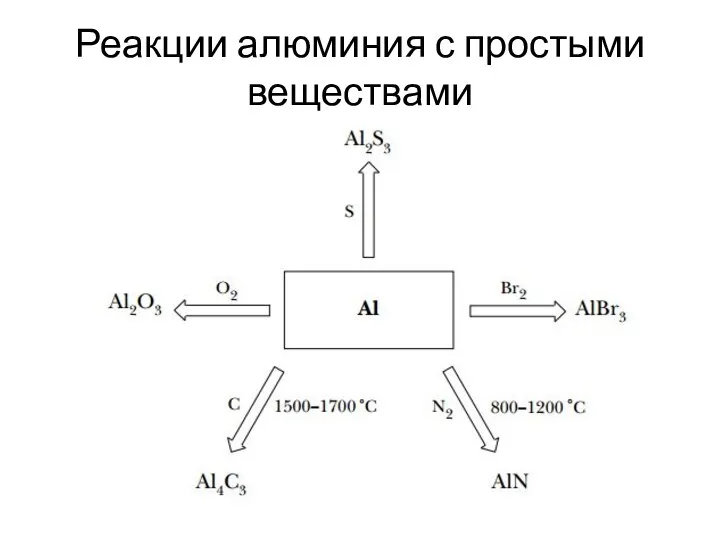
Слайд 8Реакции со сложными веществами

Слайд 10Взаимодействие со щелочами и солями

Слайд 11Соединения алюминия
Оксид алюминия
Al2O3 O=Al–O–Al=O
Глинозем, корунд, окрашенный – рубин (красный), сапфир (синий). Кристаллическая

решетка атомная.
Твердое тугоплавкое (t°пл.=2050°С) вещество; существует в нескольких кристаллических модификациях (a – Al2O3, g – Al2O3).
Получение
4Al + 3O2 = 2Al2O3
2Al(OH)3 = Al2O3 + 3H2O
Слайд 15Задание № 32
Порошок металлического алюминия смешали с твердым иодом и добавили несколько

капель воды. К полученной соли добавили раствор гидроксида натрия до выпадения осадка. Образовавшийся осадок растворили в соляной кислоте. При последующем добавлении раствора карбоната натрия вновь наблюдали выпадение осадка.













 Алмаз Подготовила: УЧЕНИЦА 9 «А» КЛАССА КАЗИЕВА МАРЖАН
Алмаз Подготовила: УЧЕНИЦА 9 «А» КЛАССА КАЗИЕВА МАРЖАН Спирты и их производные. Применение метанола и этанола
Спирты и их производные. Применение метанола и этанола Презентация на тему Выбирай вопрос и отвечай
Презентация на тему Выбирай вопрос и отвечай  Разминка
Разминка Введение в химию. История химии
Введение в химию. История химии Образование первичной структуры белка
Образование первичной структуры белка Практическое пособие по твердофазной экстракции
Практическое пособие по твердофазной экстракции Амины. Аминокислоты. Белки
Амины. Аминокислоты. Белки Классификация химических реакций. Окислительно-восстановительные реакции
Классификация химических реакций. Окислительно-восстановительные реакции Соли. Химические свойства
Соли. Химические свойства Nanotechnology (theoretical part)
Nanotechnology (theoretical part) Научный эксперимент в химической технологии
Научный эксперимент в химической технологии Презентация на тему Типы реакций
Презентация на тему Типы реакций  Способы получения веществ 14 (IVА) группы элементов
Способы получения веществ 14 (IVА) группы элементов Игра Что? Где? Когда?. Химия
Игра Что? Где? Когда?. Химия Реакции ионного обмена. Задания. 9 класс
Реакции ионного обмена. Задания. 9 класс Органическая химия: Жиры
Органическая химия: Жиры Получение дисперсных систем. Метод конденсации. Метод диспергирования. Эффект Ребиндера. Лекция 11
Получение дисперсных систем. Метод конденсации. Метод диспергирования. Эффект Ребиндера. Лекция 11 Презентация на тему Классификация неорганических веществ. Оксиды
Презентация на тему Классификация неорганических веществ. Оксиды  Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН
Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН Химическая шкатулка
Химическая шкатулка Образование и получение веществ
Образование и получение веществ Биологическое значение брома и йода
Биологическое значение брома и йода Презентация на тему Щелочноземельные металлы
Презентация на тему Щелочноземельные металлы  Презентация на тему Химия и современный мир профессий
Презентация на тему Химия и современный мир профессий  Циклоалканы. Номенклатура и строение
Циклоалканы. Номенклатура и строение Угольная кислота
Угольная кислота Презентация на тему Обобщение: предельные и непредельные углеводороды
Презентация на тему Обобщение: предельные и непредельные углеводороды