Содержание
- 2. Что это такое? Бу́ферные систе́мы кро́ви (от англ. buff — «смягчать удар») — физиологические системы и
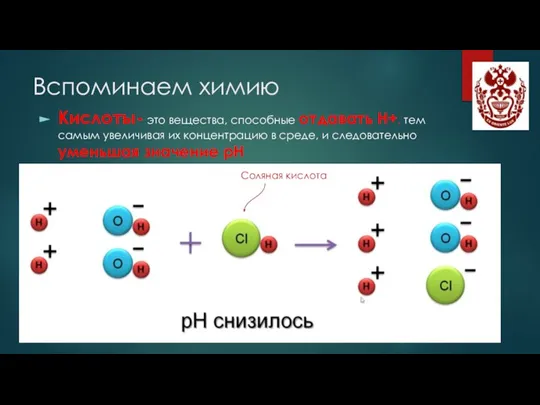
- 3. Вспоминаем химию Кислоты- это вещества, способные отдавать Н+, тем самым увеличивая их концентрацию в среде, и
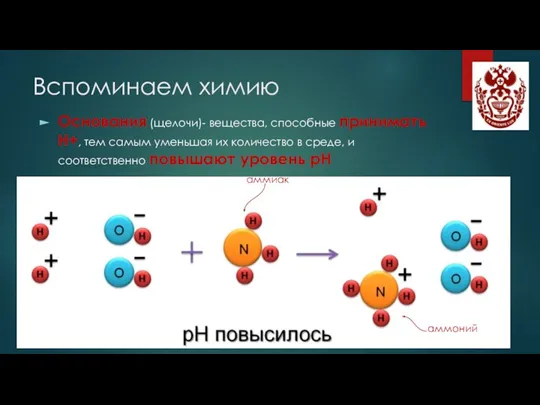
- 4. Вспоминаем химию Основания (щелочи)- вещества, способные принимать Н+, тем самым уменьшая их количество в среде, и
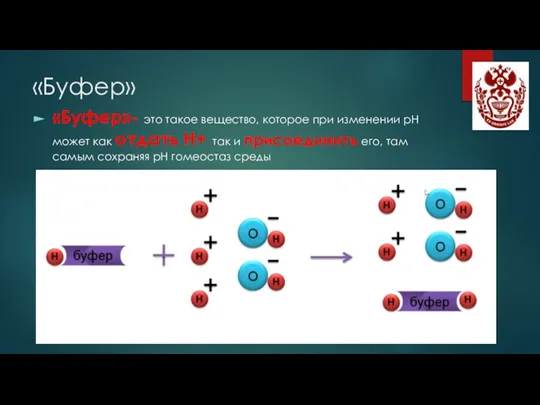
- 5. «Буфер» «Буфер»- это такое вещество, которое при изменении рН может как отдать Н+, так и присоединить
- 6. Значения рН Нейтральный рН (внутри клетки) = 6.8 Оптимальные значения рН крови= 7.35-7.45 (сред. 7.4) Ацидоз
- 7. Зачем нужно поддерживать opt рН?
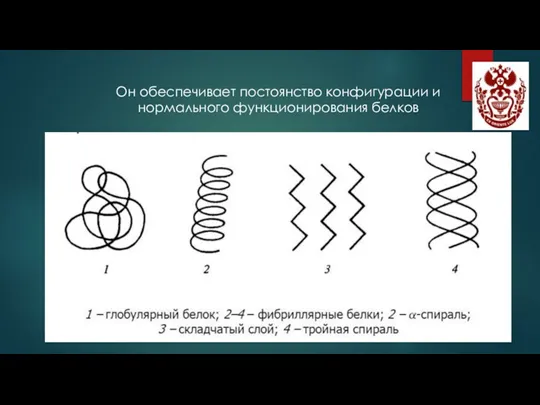
- 8. Он обеспечивает постоянство конфигурации и нормального функционирования белков
- 9. Даёт возможность работать механизму «клеточной ловушки»
- 10. Какие они бывают? бикарбона́тная фосфа́тная белко́вая гемоглоби́новая
- 11. Бикарбонатная Б.С. Мощная и самая управляемая система внеклеточной жидкости и крови Составляет ок.10% всей буферной емкости
- 12. Бикарбонатная Б.С. При нормальном значении рН крови (7,4) концентрация ионов НСО3 больше конц. СО2 примерно в
- 13. Бикарбонатная Б.С. Механизм: при выделении в кровь относительно больших количеств кислых продуктов (более сильной кислоты, чем
- 14. Бикарбонатная Б.С. Если увеличивается количество оснований- то основания забирают у угольной кислоты протон и на «выходе»
- 15. Фосфатная буферная система Это сопряженная кислотно-основная пара, состоящая из иона Н2РО4– (донор ) и иона НРО42–
- 16. Фосфатная буферная система При взаимодействии Na2HPO4 с какой- либо введенной в систему кислотой образуется нейтральная соль
- 17. Фосфатная буферная система При поступлении в кровь оснований избыток ОН–‑групп нейтрализуется кислотными Н+, а расход ионов
- 18. Фосфатная буферная система Буферная пара (Н2РО4––НРО42–) способна оказывать влияние при изменениях рН в интервале от 6,1
- 19. Белковая буферная система Имеет меньшее значение для поддержания КОР в плазме крови, Белки образуют буферную систему
- 20. Белковая буферная система Белковая буферная система плазмы крови эффективна в области значений рН 7,2–7,4.
- 21. Гемоглобиновая буферная система Самая мощная БС, в 9 раз мощнее бикарбонатного буфера Составляет 75% от всей
- 22. Гемоглобиновая буферная система Итак, гемоглобиновая БС состоит из неионизированного гемоглобина ННb (слабая кислота, донор) и калиевой
- 23. Гемоглобиновая буферная система Буферные свойства гемоглобина обусловлены возможностью взаимодействия кислот с калиевой солью гемоглобина с образованием
- 24. Гемоглобиновая буферная система Гемоглобин (ННb), попадая в капилляры легких, превращается в окси-гемоглобин (ННbО2), что приводит к
- 26. Скачать презентацию


















 Прямая реставрация передней группы зубов (зубов 1.2-2.2)
Прямая реставрация передней группы зубов (зубов 1.2-2.2) Аритмии сердца
Аритмии сердца Пренатальная гимнастика. Часть 2
Пренатальная гимнастика. Часть 2 Босануды қоздыру. Көрсеткіштері, қарсы көрсеткіштері, асқынулары. Амниотомия
Босануды қоздыру. Көрсеткіштері, қарсы көрсеткіштері, асқынулары. Амниотомия Рентгенологическая диагностика переломов
Рентгенологическая диагностика переломов Ингибиторы циклооксигеназы
Ингибиторы циклооксигеназы Строение и топография сердца
Строение и топография сердца Воспалительные заболевания женских половых органов
Воспалительные заболевания женских половых органов Организация ухода за новорожденным ребенком
Организация ухода за новорожденным ребенком Топографическая анатомия области головы
Топографическая анатомия области головы Особенности эпидемического процесса при туляремии
Особенности эпидемического процесса при туляремии Анализ клинического случая и обсуждение плана лечения
Анализ клинического случая и обсуждение плана лечения Ноотропные ЛС. Лекция № 17
Ноотропные ЛС. Лекция № 17 Судебно медицинская экспертиза огнестрельных повреждений
Судебно медицинская экспертиза огнестрельных повреждений Дифференциальная диагностика анемий
Дифференциальная диагностика анемий Язвы роговицы
Язвы роговицы Продолжение боль и обезболивание
Продолжение боль и обезболивание Высоковероятностная диагностика злокачественных родинок
Высоковероятностная диагностика злокачественных родинок Правила остановки артериального кровотечения
Правила остановки артериального кровотечения Инвазии, передающиеся фекально-оральным путём
Инвазии, передающиеся фекально-оральным путём Изменения сердца
Изменения сердца Профилактика геморрагических осложнений в полости рта на стоматологическом приеме при работе с пациентами
Профилактика геморрагических осложнений в полости рта на стоматологическом приеме при работе с пациентами Средства для наркоза
Средства для наркоза Эризипелоид. Этиология
Эризипелоид. Этиология Общая пропедевтика диффузных заболеваний соединительной ткани
Общая пропедевтика диффузных заболеваний соединительной ткани Болезнь Альцгеймера . Что же это ?
Болезнь Альцгеймера . Что же это ? Анализ использования методов контрацепции у пациенток
Анализ использования методов контрацепции у пациенток Дәрілік үлгілердің жіктелу жүйесі
Дәрілік үлгілердің жіктелу жүйесі