Содержание
- 2. Жоспары: Кіріспе Дәрілік заттарды тіркеу Негізгі бөлім Ұлттық тәртіп бойынша мемлекеттік тіркеу Тіркеу процедурасының қадамдары Тіл
- 3. Дәрілік заттарды тіркеу Қазақстан Республикасының «Халық денсаулығы және денсаулық сақтау жүйесі туралы» кодексіне сәйкес, Қазақстанға дәрілік
- 4. Қазақстан – айналымдағы дәрілік заттарды реттеудің жоғары стандарттары бар ел. Қаптаманың бекітілген және ағымдағы макеттері, медициналық
- 5. Ұлттық тәртіп бойынша мемлекеттік тіркеу Тіркеу тәртібі «Дәрілік заттарды, медициналық мақсаттағы бұйымдар мен медициналық техникаға сараптама
- 6. Тіркеу процедурасын келесі қадамдармен көрсетуге болады: Сараптама жүргізуге шарт жасау; Сараптамаға шот-фактураны алу және төлеу; Дәрілік
- 7. Тіркеу процесінде үлгілердің сапасын зертханалық бақылау жүргізіледі, оның мақсаттары үшін қажетті мөлшерде үлгілер мен стандарттарды импорттау
- 8. Тіл және таңбалау Қаптаманы таңбалау және медициналық қолдану жөніндегі. Нұсқаулық орыс және қазақ тілдерінде беріледі және
- 9. Тіркеу куәлігі Тіркеу куәлігі бірнеше құжаттардан тұрады: Тіркеу куәлігінің өзі; Медициналық қолдану жөніндегі нұсқаулықтың бекітілген мәтіні;
- 10. Қайта тіркеу Қайта тіркеуге өтінішті куәліктің қолданылу мерзімі аяқталғанға дейін беру қажет. Қазақстанда қайта тіркеу рәсімі
- 11. Қайта тіркеу кезінде дәрілік заттың сараптамасы күнтізбелік жүз жиырма күн ішінде, соның ішінде: 1) дәрілік заттың
- 12. Дәрілік препараттың тіркелгенін (қайта тіркелгенін) растау мақсатында өтініш беруші референттік мемлекеттің уәкілетті органына (сараптама ұйымына) мынадай
- 13. Қорытынды Осы Дәрілік затты немесе медициналық бұйымды мемлекеттік тіркеу, қайта тіркеу және оның тіркеу дерекнамасына өзгерістер
- 15. Скачать презентацию
Слайд 2Жоспары:
Кіріспе
Дәрілік заттарды тіркеу
Негізгі бөлім
Ұлттық тәртіп бойынша мемлекеттік тіркеу
Тіркеу процедурасының қадамдары
Тіл және таңбалау
Тіркеу
Жоспары:
Кіріспе
Дәрілік заттарды тіркеу
Негізгі бөлім
Ұлттық тәртіп бойынша мемлекеттік тіркеу
Тіркеу процедурасының қадамдары
Тіл және таңбалау
Тіркеу

Қайта тіркеу
Қорытынды
Пайдаланылған әдебиеттер
Слайд 3Дәрілік заттарды тіркеу
Қазақстан Республикасының «Халық денсаулығы және денсаулық сақтау жүйесі туралы» кодексіне
Дәрілік заттарды тіркеу
Қазақстан Республикасының «Халық денсаулығы және денсаулық сақтау жүйесі туралы» кодексіне

Дәрілік заттарды тіркеу «ұлттық» тәртіппен 2020 жылғы 31 желтоқсанға дейін немесе «орталықтандырылған» тәртіппен жүзеге асырылуы мүмкін; және 2020 жылдың 31 желтоқсанынан кейін ғана ЕАЭС-ның «орталықтандырылған» рәсімі бойынша.
Дайын дәрілік заттарды тіркеу сараптамасын Қазақстан Республикасы Денсаулық сақтау және халықты әлеуметтік қорғау министрлігінің «Дәрілік заттарды, медициналық мақсаттағы бұйымдарды және медициналық техниканы сараптау ұлттық орталығы» («Национальный Центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники») АҚ жүзеге асырады (сайт: http://www.ndda.kz /).
Слайд 4Қазақстан – айналымдағы дәрілік заттарды реттеудің жоғары стандарттары бар ел. Қаптаманың бекітілген

Тіркеу иесі Қазақстан Республикасының резиденті де, резидент емесі де бола алады. Тіркеушіден Қазақстан аумағында Өкілдік ашу немесе заңды тұлға құру талап етілмейді. Бұл ретте Тіркеуге өтініш беруші (құжаттаманы ұсынатын және құзыретті органдармен келіссөздер жүргізетін тұлға) резидент болуы керек.
Сондай-ақ, дәрілік затты қолдану жөніндегі
нұсқаулықта Қазақстан Республикасының аума-
ғында дәрілік заттардың сапасына шағымдарды
(ұсыныстарды) қабылдайтын және тіркеуден
кейінгі мониторингке жауапты ұйымның атауы
мен мекенжайын көрсету қажет. дәрілік заттың
қауіпсіздігі туралы.
Слайд 5Ұлттық тәртіп бойынша мемлекеттік тіркеу
Тіркеу тәртібі «Дәрілік заттарды, медициналық мақсаттағы бұйымдар мен
Ұлттық тәртіп бойынша мемлекеттік тіркеу
Тіркеу тәртібі «Дәрілік заттарды, медициналық мақсаттағы бұйымдар мен

Тіркеу деректері CTD форматында қабылданады. Дегенмен, тіркеу деректерін ұсыну үшін нақты ұлттық құжаттарды әзірлеу қажет, атап айтқанда:
Дәрілік затты тіркеу туралы өтініш;
Дайын өнімнің құрамын, шығару және жарамдылық мерзімін, сапаны бақылау әдістерін, сақтау шарттары туралы ақпаратты, өндірушілер туралы ақпаратты және т.б. қамтитын нормативтік құжат;
Медициналық қолдану жөніндегі нұсқаулық;
Бастапқы және қосалқы қаптаманың графикалық орналасулары.
Құжаттама электронды түрде ұсынылады, құжаттаманың бір бөлігі орыс және/немесе қазақ тілдеріндегі аудармасымен бірге ұсынылуы тиіс.
Әкімшілік құжаттама құжаттарды халықаралық заңдастыру талаптарын ескере отырып ұсынылады.
Слайд 6Тіркеу процедурасын келесі қадамдармен көрсетуге болады:
Сараптама жүргізуге шарт жасау;
Сараптамаға шот-фактураны алу
Тіркеу процедурасын келесі қадамдармен көрсетуге болады:
Сараптама жүргізуге шарт жасау;
Сараптамаға шот-фактураны алу

Дәрілік заттың үлгілерін және қажетті стандарттарды әкелуге рұқсат алу;
Ұлттық сараптама орталығына құжаттар мен үлгілерді ұсыну;
Емтихандарды өткізу:
- бастапқы тексеру;
- мамандандырылған сараптама
- зертханалық зерттеулер;
6. Қажет болған жағдайда өндіріс орнын тексеру;
7. Қорытынды құжаттарды келісу;
8. Дәрілік заттың қауіпсіздігі, тиімділігі және сапасы туралы қорытынды алу;
9. Денсаулық сақтау министрлігіне дәрілік затты тіркеуге өтінім беру;
10. Тіркеу жарнасын төлеу;
11. Бұйрық шығару, тіркеу куәлігін алу.
Слайд 7Тіркеу процесінде үлгілердің сапасын зертханалық бақылау жүргізіледі, оның мақсаттары үшін қажетті мөлшерде
Тіркеу процесінде үлгілердің сапасын зертханалық бақылау жүргізіледі, оның мақсаттары үшін қажетті мөлшерде

Дәрілік затты мемлекеттік тіркеу үшін сараптама жұмысын жүргізу мерзімі 7 айды құрайды (сараптамалық зерттеу кезінде анықталған ескертулерді жою, өндірісті бағалауды ұйымдастыру үшін өтініш берушіге берілген мерзімдерді қоспағанда, күнтізбелік 210 күннен аспайды). шарттар мен сапа қамтамасыз ету жүйесі, клиникаға дейінгі, клиникалық зерттеулер жүргізу, фармакологиялық қадағалау жүйелері, қорытынды құжаттарды бекіту).
Тіркеу кезінде Ұлттық сараптама орталығы Өтініш беру-
шіден дәрілік заттың сапасына, қауіпсіздігіне және тиімді-
лігіне қатысты қажетті қосымша материалдарды сұратуға
құқылы. Өтініш берушіге бұл ескертулерге жауап беру н\е
оларды беру мерзімін негіздеу үшін 60-90 күн бар. Өтініш
беруші сұралған деректерді ұсынбаған немесе оларды то-
лық ұсынбаған жағдайда тіркеу материалдары қараудан
алынып тасталады, ал төленген қаражат қайтарылмайды.
Слайд 8Тіл және таңбалау
Қаптаманы таңбалау және медициналық қолдану жөніндегі. Нұсқаулық орыс және қазақ
Тіл және таңбалау
Қаптаманы таңбалау және медициналық қолдану жөніндегі. Нұсқаулық орыс және қазақ

Дәрілік заттар мен медициналық бұйымдарды таңбалауға
қойылатын талаптар "дәрілік заттар мен медициналық бұйымдарды
таңбалау қағидаларын бекіту туралы"ҚР ДСМ 2015 жылғы 16 сәуірдегі
№227 бұйрығымен бекітілген. Графикалық ресімдеу үлгілері тіркеу
рәсімінен кейін бекітіледі және сайтқа орналастырылады.
Слайд 9Тіркеу куәлігі
Тіркеу куәлігі бірнеше құжаттардан тұрады:
Тіркеу куәлігінің өзі;
Медициналық қолдану жөніндегі нұсқаулықтың бекітілген
Тіркеу куәлігі
Тіркеу куәлігі бірнеше құжаттардан тұрады:
Тіркеу куәлігінің өзі;
Медициналық қолдану жөніндегі нұсқаулықтың бекітілген

Бастапқы және қайталама қаптаманың бекітілген түсті макеттері;
Келісілген Талдамалық нормативтік құжат (өнімнің құрамын, шығаруға арналған ерекшелікті және жарамдылық мерзімін, сапаны бақылау әдістерін және т.б. қамтиды).
Тіркеу куәлігінің қолданылу мерзімі 5 жылды құрайды.
Әдетте, қатаң реттеу саясаты бар елдерде тіркелген
өнімдер үшін қайта тіркеу рәсімінен кейін мерзімсіз
тіркеу куәлігі беріледі. ТҚ қолданылу кезеңінде
айналымға түскен дәрілік зат жарамдылық мерзімі
өткенге дейін сатуға жіберіледі.
Слайд 10Қайта тіркеу
Қайта тіркеуге өтінішті куәліктің қолданылу мерзімі аяқталғанға дейін беру қажет. Қазақстанда
Қайта тіркеу
Қайта тіркеуге өтінішті куәліктің қолданылу мерзімі аяқталғанға дейін беру қажет. Қазақстанда

өтініш берушіге ұсынылған мерзімдерді қоспағанда,
күнтізбелік 120 күннен аспайды.Қайта тіркеуді жүргізу
нәтижелері бойынша бес жыл мерзімге (немесе
мерзімсіз) тіркеу куәлігі беріледі."Кратия" компаниясы
Қазақстанда дәрілік заттарды тіркеу бойынша
жұмыстарды кәсіби орындайды. Біз ұлттық заңнаманы
және тілді меңгереміз, жұмыстарды орындау үшін
қажетті тәжірибеміз бен ресурстарымыз бар.
Слайд 11Қайта тіркеу кезінде дәрілік заттың сараптамасы күнтізбелік жүз жиырма күн ішінде, соның
Қайта тіркеу кезінде дәрілік заттың сараптамасы күнтізбелік жүз жиырма күн ішінде, соның

1) дәрілік заттың бастапқы сараптамасы (тіркеу дерекнамасының валидациясы) - күнтізбелік жиырма күн;
2) мамандандырылған сараптама - күнтізбелік тоқсан күн, оның ішінде зертханалық сынақтар (cоның ішінде дәрілік заттың жалпы сипаттамасының және медициналық қолдану жөніндегі нұсқаулықтың (қосымша парақ), қаптама макеттері таңбалануының,
заттаңбалардың, стикерлердің қазақ тіліне аудармасы немесе
тең түпнұсқалығын тексеру күнтізбелік он бес күн ішінде);
3) қауіпсіздік, тиімділік және сапа туралы қорытындыны
қалыптастыру – күнтізбелік он күн.
Слайд 12Дәрілік препараттың тіркелгенін (қайта тіркелгенін) растау мақсатында өтініш беруші референттік мемлекеттің уәкілетті
Дәрілік препараттың тіркелгенін (қайта тіркелгенін) растау мақсатында өтініш беруші референттік мемлекеттің уәкілетті

а) осы Қағидаларға № 2 қосымшаға сәйкес белгіленген нысан бойынша қағаз жеткізгіште және (немесе) электрондық құжат түрінде дәрілік
препараттың тіркелгенін(қайта тіркелгенін)растау туралы өтініш;
б) референттік мемлекеттің заңнамасына сәйкес белгіленген
жағдайда және тәртіппен тіркеуді (қайта тіркеуді) және
сараптаманы растау үшін алым (баж) төленгенін растайтын
құжаттар;
в) осы Қағидаларға № 1-5 қосымшаларға сәйкес электрондық
тасымалдағышта дайындалған тіркеу деректерінің 1 және 2 модульдері.
Слайд 13Қорытынды
Осы Дәрілік затты немесе медициналық бұйымды мемлекеттік тіркеу, қайта тіркеу және оның
Қорытынды
Осы Дәрілік затты немесе медициналық бұйымды мемлекеттік тіркеу, қайта тіркеу және оның

 Зубы. Виды и строение зубов
Зубы. Виды и строение зубов Lekarstvennaya_ustoychivost
Lekarstvennaya_ustoychivost Заболевания молочной железы
Заболевания молочной железы Фармацевтическая опека
Фармацевтическая опека Гиполипидемические средства
Гиполипидемические средства Острая печеночная недостаточность у детей и ее этиологическая связь с инфекциями вирусами группы герпеса
Острая печеночная недостаточность у детей и ее этиологическая связь с инфекциями вирусами группы герпеса Профилактика пищевых инфекций
Профилактика пищевых инфекций Посторонние элементы в осадке мочи. Бактерии, гельминты (яйца гельминтов), патогенные простейшие в осадке мочи
Посторонние элементы в осадке мочи. Бактерии, гельминты (яйца гельминтов), патогенные простейшие в осадке мочи Антиаритмические лекарственные средства
Антиаритмические лекарственные средства Зрение. Как его сохранить
Зрение. Как его сохранить Эффективная забота о нейрореанимационном пациенте
Эффективная забота о нейрореанимационном пациенте Қыз баланы жыныстық тәрбиелеу
Қыз баланы жыныстық тәрбиелеу Covid-19 для интенсивиста. Эпидемиологическая безопасность при ИВЛ
Covid-19 для интенсивиста. Эпидемиологическая безопасность при ИВЛ ДВС-синдром у беременных. Геморагический шок. Эмболия околоплодными водами
ДВС-синдром у беременных. Геморагический шок. Эмболия околоплодными водами Клапанный аппарат сердца и его работа
Клапанный аппарат сердца и его работа Искусство мануальных
Искусство мануальных Колоректальный рак
Колоректальный рак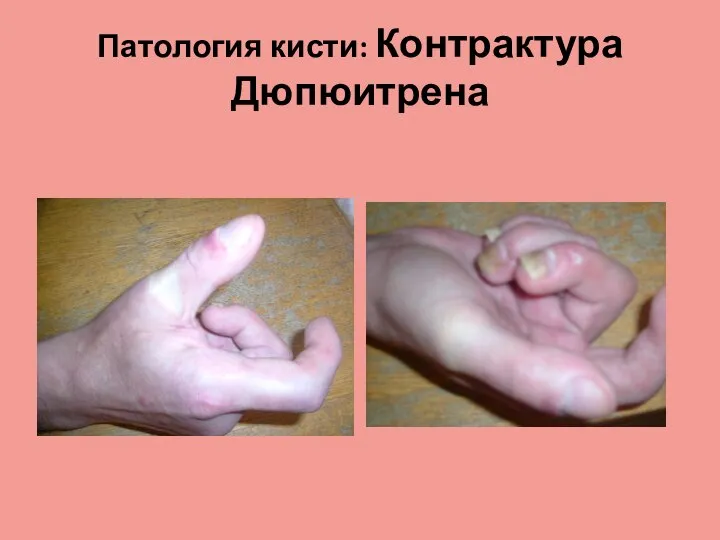 Патология кисти
Патология кисти Термические аварии
Термические аварии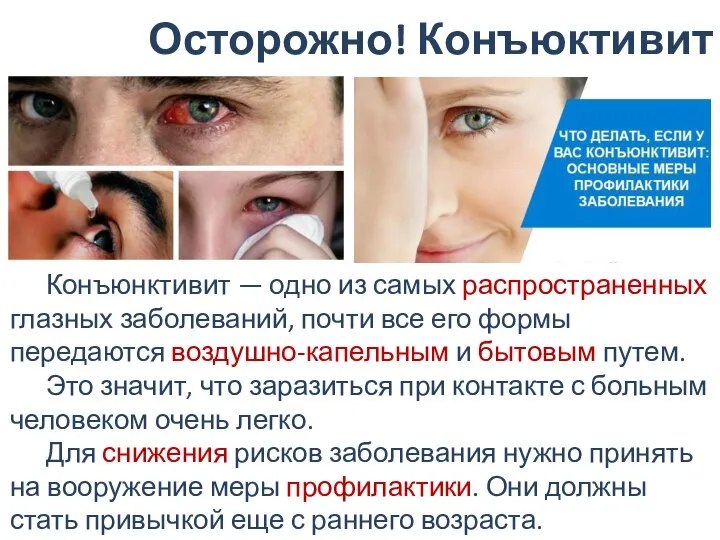 Конъюнктивит. Меры профилактики
Конъюнктивит. Меры профилактики Малярия
Малярия Система мониторинга оказания специализированной медицинской помощи
Система мониторинга оказания специализированной медицинской помощи Совет студентов медицинских и фармацевтических вузов
Совет студентов медицинских и фармацевтических вузов Подготовка универсальной укладки в бикс для стерилизации
Подготовка универсальной укладки в бикс для стерилизации Общая и частная психопатология: определение, методические подходы диагностики, лечения, профилактики
Общая и частная психопатология: определение, методические подходы диагностики, лечения, профилактики Центр по лечению ХСН, маршрутизация пациентов с ХСН
Центр по лечению ХСН, маршрутизация пациентов с ХСН лекция 4
лекция 4 Наблюдение и уход за детьми грудного возраста
Наблюдение и уход за детьми грудного возраста